最大的放松梦想:像猫一样在阳光下睡着。
治疗爱滋病的药物分子 nevirapine 真的具有手性吗?
上一篇 /
下一篇 2010-12-18 15:23:11
Nevirapine 是用于治疗爱滋病的药物,它是一个 HIV1 reverse transcriptase 的抑制剂。
近日,几个印度人声称从天然产物中找到了这个分子,而且是纯手性的【1】。那篇文章由于缺乏足够的数据引起一个博客和大量读者的质疑【2-3】。(是的,
在这一点上,它和前些日子《科学》杂志的“砷基生命”文章有点相似)
科学网上的化学人士也不少,那么你们看看下面它的二维结构:说说看,它哪来的手性啊?
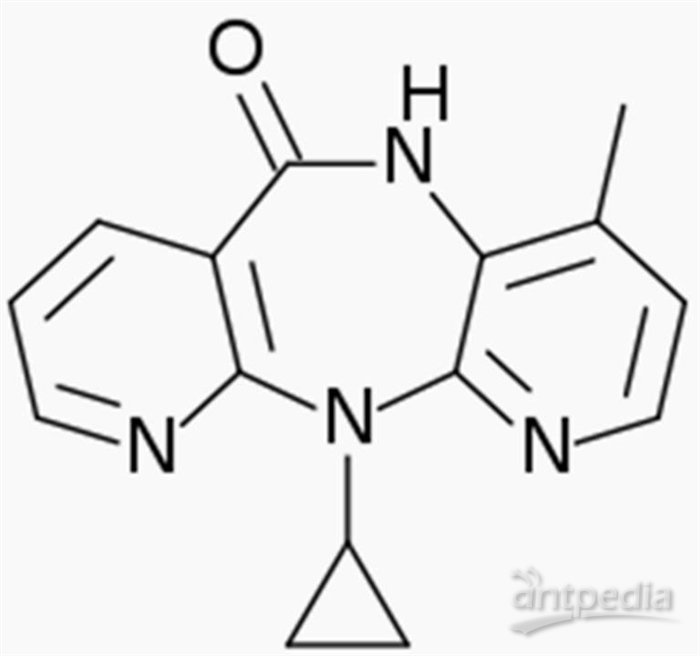
我昨天查了一下剑桥小分子晶体结构数据库(CSD),下载了所有找到的结构,再进行分子叠合(superposition)。有意思,确实存在两个
不同的结构,而且有一个晶体里面就同时存在两个结构【4】。下面是那两个结构放在一起的效果,看来真是有手性了。这应该是由于分子内的空间障碍(张力)使
得3个共轭的环没有在同一个平面,两种不同的pucking导致2个不同的结构。


问题是两个结构的能量差别是多少(估计会很小),两者之间相互转换的过渡态能量又有多高。如果那个能垒不大的话,两个结构之间就可能互相转换,就谈
不上手性了。 这就需要做些高精度的能量计算了,谁有时间和兴趣可以试试,至少可以发篇JACS的通讯吧。不过,发表文章的时候别忘了引用一起我的博客,
呵呵。
另外,我查了一下它在PDB数据库的结构。虽然蛋白会有些细微的差别,比如一两个mutations,而小分子的结构叠合之后几乎完全相同。感兴趣的分子模拟者可以试试CSD中的另外一个结构是否可以对接到蛋白的活性中心。有意思的是,这么一个有名的药物分子竟然和蛋白之间几乎没有任何极性相互作用。难道分子中的那些极性原子只是为了溶解度和其它物理性质?很明显,对于这个体系,分子形状和蛋白活性中心空腔的匹配是非常的重要。
【更正,nevirapine 和 HIV1 reverse transcriptase
结合时,并不是作用在酶的活性中心,而是距离大概10A的一个allosteric site。不过,nevirapine 结合上去之后,改变了那个酶
的活性中心结构,使得它失去了活性:病毒的RNA到DNA的转换通道就被截断了。 】
相关阅读:
- 【回眸2009】液相色谱手性制备分离过程中的几个关键问题探讨 (aa_tang, 2010-2-28)
- 关于手性有机催化方面的文章 (lclong0213ng, 2010-4-12)
- 手性苯乙胺在有机中的应用review两篇 (dragon5, 2010-4-14)
- 手性药物的结晶拆分方法--直接结晶法---逆向结晶法 (dragon5, 2010-4-14)
- 周其林的手性简单介绍 (maicaixiaogu, 2010-4-15)
- 化学所在二维手性Kagome结构研究方面取得新进展 (snwxf, 2010-5-28)
- 双金属协同催化合成手性氰醇衍生物研究获进展 (snwxf, 2010-9-14)
- DNA在核小体上的手性你注意了吗 (实验技术, 2010-9-20)
- 祝贺安东帕在2010手性中国会议展出圆满成功 (snwxf, 2010-10-20)
- “一体两型三化”——多糖类手性柱的美好时代 (aa_tang, 2010-11-01)
导入论坛收藏
分享给好友
推荐到圈子
管理
举报
TAG: 手性爱滋病药物分子




