浅论第三条大分子生命链糖链
上一篇 / 下一篇 2011-10-23 19:40:35/ 个人分类:糖
第三条大分子生命链——糖链 江苏大学学报 医学版
2009年05期 中文版 陈惠黎
(卫生部糖复合物重点实验室, 复旦大学上海医学院生物化学与分子生物学系,上海 200032)
【关键词】 糖链; 糖蛋白; 糖脂; 蛋白聚糖
生命现象的分子基础主要依赖于生物大分子及其相关的一些小分子。生物化学研究人员一直认为:生物体内组成蛋白质的氨基酸链(肽链)、组成核酸(RNA和DNA)的核苷酸链以及存在于脂类(包括中性脂肪、磷脂和糖脂)中的脂肪酸链是体现生命活动的三个生命链。但其中的脂肪酸链是一个单一的小分子,其组成单位是CH3,CH2,CH= (=CH)和-COOH等化学基团,而不是在化学意义上的分子。只有蛋白质和核酸是真正的生物大分子。20世纪70年代左右,人们才认识到生物体内另一类由不同单糖组成链状结构的糖链在生命活动中的重要性。糖链是除蛋白质肽链和核酸链以外体现生命现象的第三类大分子的生命链,糖复合物的研究已被公认为继蛋白质和核酸的研究后探索生命奥秘的第三个里程碑。
无可置疑,蛋白质是生命现象的重要体现者,其功能多种多样。如肌肉收缩靠的是肌肉中的肌球蛋白和肌动蛋白,血液运输氧分子依赖于红细胞中的血红蛋白,食物的消化和新陈代谢又仰仗于有催化作用的酶蛋白。另一方面,蛋白质肽链中氨基酸的排列顺序依赖于核酸链中4种核苷酸的排列顺序。核酸是遗传信息的保持者,而遗传信息流向的中心法则是DNA(含A,G,C,T 4种核苷酸)→RNA(含A,G,C,U 4种核苷酸) →蛋白质。
近年来发现,糖链能影响糖蛋白肽链的折叠、聚合、溶解和降解,还参与糖蛋白的分拣(sorting)和投送(trafficking)等细胞过程,而这些功能的主要机制是:糖链参与细胞和分子的生物学识别(recognition),如受体和配体、细胞和间质、细胞和细胞、细胞和病原体等。这些功能是细胞的高级功能,只有当生物进化到多细胞时才能具备。如以细胞比作国家,那么处于细胞内的蛋白质和核酸主管内政,而处于细胞膜上的糖链则主管外交。用电子显微镜可看到,细胞膜的外面被一层糖链所包裹,就足以证明这一点。糖链之所以能负起分子识别的重任,是因为它的结构中含有较蛋白质和核酸。
生物界中的糖链主要有四大类。
1.1 糖蛋白中的糖链
人体内的蛋白质有三分之一以上是糖蛋白(glycoprotein),存在于各种组织和不同细胞中,绝大多数的血浆蛋白质也是糖蛋白。糖蛋白是蛋白质和糖类的共价复合物,其中的糖基少则一个,多则数百个,故糖蛋白的含糖量可低至2%,高至50%以上。由糖基连成的糖链又称为寡糖链(oligosaccharide chain)或称聚糖(glycan)。蛋白质肽链可在不同部位结合一个以上的糖基或糖链。
根据糖链在肽链上的连接位点,主要有天冬酰胺(Asn)连接和丝氨酸或苏氨酸(Ser/Thr)连接两大类。
(1) 前者是糖链通过还原端的N-乙酰氨基葡萄糖(GlcNAc)以β1,4键和蛋白质肽链中Asn的酰胺氮连接,故称为N(或Asn)连接型糖链或N-糖链;
(2) 后者是糖链通过还原端的N-乙酰氨基半乳糖(GalNAc)以α1,4键和蛋白质肽链上Ser或Thr的氧原子(O)连接,故称为O-GalNAc连接型糖链,简称O-糖链。
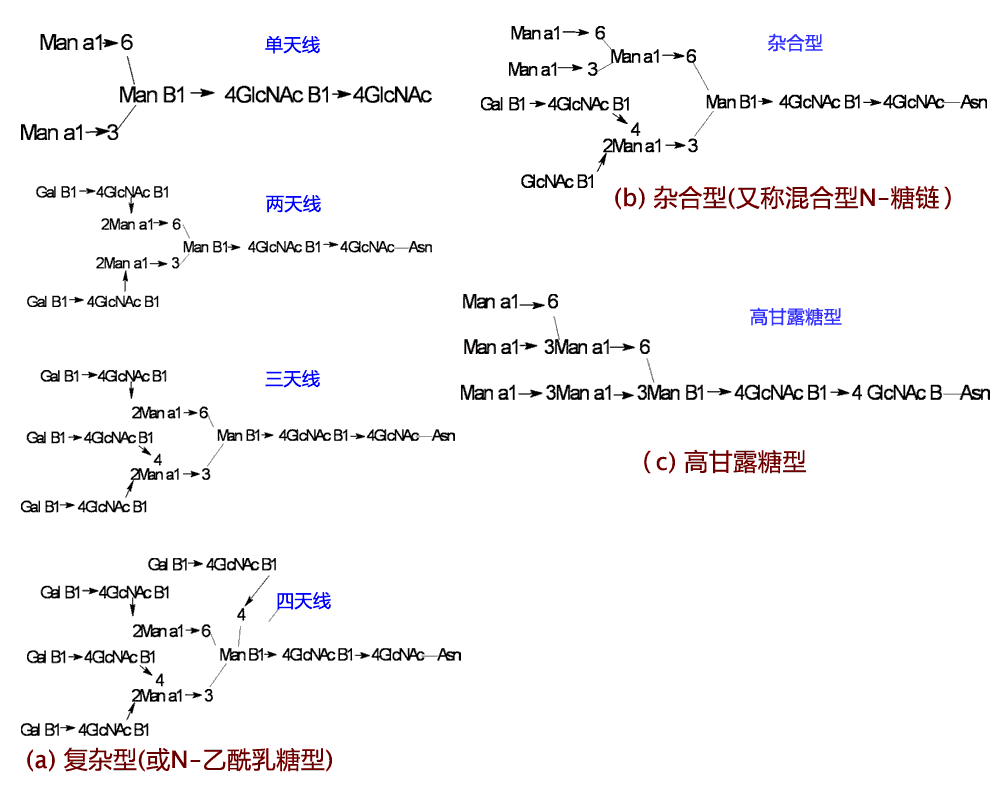
(1) 能被N-糖基化的Asn位点必须处于Asn、Xaa、Ser/Thr(或NXS/T)序列子(sequon)中,其中Xaa可以是Pro以外的任何氨基酸。N-糖链都有一个由3个甘露糖(Man)和2个GlcNAc组成的分支的五糖核心(Man3GlcNAc2,图1)。
(a) 复杂型(b) 杂合型 (c)高甘露糖型
图1 三型N-聚糖及其核心部分的结构
核心外侧的两个Man分别以α1,3键和α1,6键连接于内侧的一个Man,组成糖链的1,3和1,6臂,而内侧的Man又以β1,4键连接于由两个GlcNAc以β1,4键相连的二糖。最内侧GlcNAc再和Asn连接。五糖核心外侧的糖基组成外链,可含有GlcNAc、半乳糖(Gal)、唾液酸(SA)等。酸性N-糖链的外端一般是唾液酸,高等动物中的SA主要是乙酰神经氨酸(NeuAc),中性糖链则一般以Gal或岩藻糖(Fuc)为外端。很少数的N-糖链可含N-乙酰氨基半乳糖(GalNAc)和末端硫酸基团。N-糖链又可根据其1,3和1,6臂相连的外链中的糖基是单纯的Man或者含有GlcNAc,Gal,SA等多种糖基而分为高甘露糖型、杂合型和复杂型三类(图1)。
实际上,在哺乳动物体内,高甘露糖型和杂合型是复杂型合成时的中间产物。复杂型N-糖链五糖核心的内侧Man有时还可有以β1,4连接的GlcNAc,称为平分型GlcNAc;而核心内侧的GlcNAc可以α1,6键连接1个Fuc, 称为核心Fuc(图1)。 此外,复杂型N-糖链中1,3臂的Man可在其第2位和第4位分别以β1,2和β1,4键连接一个或两个GlcNAc;而1,6臂的Man则可在其第2位和第6位分别以β1,2和β1,6键连接一个或两个GlcNAc。结果复杂型N-糖链可带有1~4条外链(又称天线),所以,有单、双、三、四天线的复杂型N-糖链之分。
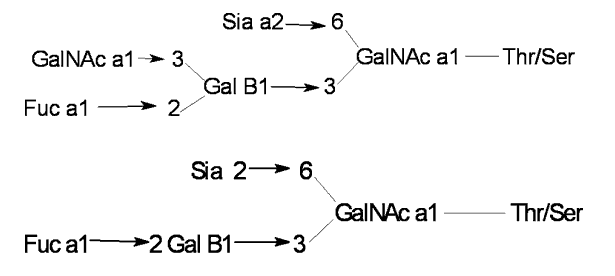
(2) O-糖链又称黏蛋白(mucin)型糖链,因黏蛋白中O-糖链的含量最高。一条肽链可连接数条或数十条O-糖链,可和N-糖链并存于同一肽链上。其糖基最少只有一个GalNAc,多达数十个以上。糖链中的糖基组成除GalNAc外,尚含有Gal和GlcNAc。酸性的O-GalNAc糖链外侧末端也含有 SA。有时糖链外端也可含Fuc,但整个糖链不含Man。O-糖链的结构远比N-糖链多样而复杂,已发现至少有8种不同的核心结构(图2)。核心或外链都可分支或不分支。
图2 O-糖链的结构举例
1.2 糖脂中的糖链
糖脂是糖类通过还原末端以糖苷键与脂类相连的共价复合物。按其中脂类的不同可分为含神经酰胺(ceramide,Cer) 即脂肪酰鞘氨醇(fatty acylsphingosine)的鞘糖脂(glycosphingolipid,GSL)和含甘油脂(glycerolipids)的甘油糖脂(glycoglycerolipids)等。鞘糖脂和甘油糖脂分别为哺乳动物和植物/微生物中的主要糖脂。鞘糖脂又分为只含中性糖(除Gal,GlcNAc和GalNAc外,还含葡萄糖Glc)的中性鞘糖脂和除中性糖外还有唾液酸或硫酸的酸性鞘糖脂。凡含唾液酸的称为神经节苷脂,而含硫酸的则称为硫苷脂。中性鞘糖脂还可按所含核心糖链中糖基的种类、内外排列顺序和糖基间连接键的不同分成9个系列,其共同特点是最内侧的糖基(还原末端)都是Glc,后者以β键连接在神经酰胺的1位上。只有半乳糖系列例外,其还原末端是Gal。表1列出了哺乳动物中6种重要中性鞘糖脂系列的结构。
表1 6种重要系列中性鞘糖脂的名称、符号及核心糖链的结构
1.3 蛋白聚糖中的糖链
蛋白聚糖(proteoglycan,PG)是糖胺聚糖(glycoaminoglycan,GAG)和其核心蛋白的共价连接物,而糖胺聚糖是带有多聚阴离子的糖链,由氨基己糖(Gal,GalNAc,GlcNAc)和己糖醛酸(葡萄糖醛酸GlcUA和艾杜糖醛酸IdoUA)或半乳糖单位组成。它们在糖链中交替排列形成二糖单位,且在不同部位具有硫酸取代基。糖胺聚糖是相对分子质量最大且结构最复杂的糖链。一条糖链中的二糖单位可有数百个至上万个。如透明质酸(hyaluronic acid)的二糖单位是[GlcUAβ1,3GlcNAcβ1,4],可多至25 000个,硫酸软骨素(chondroitin sulfate)的二糖单位是[GlcUAβ1,3GalNAcβ1,4],约有250~750个,在有些GalNAc的C2和C6位上还可发生硫酸化。肝素(heparin)的二糖单位是[IdoUAα1,4GlcNAcα1,4],并在IdoUA的C2和GlcNAc的C6、C2上有硫酸化(GlcNAc糖基C2上的硫酸化取代了乙酰化)。
在糖胺聚糖长链和核心蛋白的连接区域还有一段糖链,它们可以是与Ser/Thr连接的O糖链或与Asn连接的N糖链(如硫酸角质素与其核心蛋白的连接),也可以是糖蛋白所没有的GlcUAβ1,3Galβ1,3Galβ1,4Xylose四糖,其中Xylose(木糖)的C2位还被磷酸化,而磷酸木糖则与蛋白质肽链上的Ser相连(如硫酸软骨和硫酸乙酰肝素与其核心蛋白的连接)。但是,透明质酸一般没有核心蛋白而以游离形式存在,这是唯一的例外。
蛋白聚糖不仅分布于细胞外基质,还可存在于细胞表面,其核心蛋白的疏水肽段可插入细胞膜的脂双层,或者核心蛋白与糖基磷脂酰肌醇共价结合而锚定在细胞膜上。细胞分泌颗粒及细胞核中也发现有核心蛋白存在。现已知道:糖胺聚糖和蛋白聚糖的功能不单是充实细胞间质、维持组织的弹性和细胞的黏性;还可与其他生物大分子包括一些细胞因子,如纤维生长因子2(FGF2)、血管上皮生长因子(VEGF)和转化生长因子β(TGFβ)等结合,作为细胞因子的共受体(coreceptor),参与细胞功能的调节,如生长,分化,黏附和能量代谢等。
1.4 糖基磷脂酰肌醇(glycosylphosphatidylinosital,GPI)中的糖链
GPI是以Man为主的糖链和磷脂酰肌醇(又称肌醇磷脂)通过糖链还原端(一般是氨基葡萄糖GlcN)形成的共价复合物。肌醇磷脂含有二酰甘油和磷酸肌醇,其肌醇的C6位与GlcN的C1位以α糖苷键相连,而二酰甘油的长脂肪链则插入细胞膜的脂双层,而糖链非还原端的Man则通过磷酸乙醇胺可和蛋白质的羧基连接。所以,这类糖链的功能主要是将细胞表面的蛋白质锚定在细胞膜上。这些蛋白质包括水解酶和黏附分子等。
1.5 植物多糖、真菌多糖、细菌表面多糖和动物外壳多糖
这些种类的多糖典型代表有植物中的人参多糖、枸杞多糖,真菌中的香菇多糖、云芝多糖、茯苓多糖,革兰阴性菌荚膜上的杂多糖,水产虾蟹外壳的壳多糖等。这些多糖一般是含有主链和分支侧链的纯多糖或杂多糖。
本文重点讨论糖蛋白上糖链的功能。
2 糖蛋白上糖链的主要功能
2.1 N-糖链的识别功能对肽链正确折叠的贡献及其和疾病的关系
N-糖链生物合成的前身是一个含有14个糖基(Glc3Man9GlcNAc2)的G寡糖。后者在加工成二天线N糖链时,G寡糖α1,3 Man臂外端的3个葡萄糖须经α葡萄糖苷酶予以切除。其中和Man相连的第3个Glc能被内质网上作为分子伴侣的钙联蛋白(calnexin)或钙网蛋白(calreticulin)识别和结合。这一过程与糖蛋白肽链的正确折叠有关。如以α葡萄糖苷酶抑制剂,如N丁基脱氧诺吉利霉素(Nbutyldeoxynojirimycin,NBDNJ)抑制第1和第2个Glc的切除,使第3个Glc不能暴露,肽链也就不能正确折叠。
乙型肝炎病毒HBV的外壳蛋白有大(L)、中(M)、小(S)3种,是利用相同读框而不同的起始位点经翻译而成,其中M蛋白的前S2(Pro S2)区中第4位的Asn糖化位点与病毒蛋白的整合和分泌有关。在NBDNJ存在下,分泌HBV的细胞中因M蛋白肽链不能正确折叠而使M蛋白也不能和S和L蛋白整合,这些蛋白就以较小的仅有S蛋白的亚病毒颗粒分泌出来,颗粒中没有DNA,也就没有感染性。NBDNJ已在作为乙肝模型的土拨鼠中证明能抑制有完整外壳的病毒分泌,故α葡萄糖苷酶抑制剂有望成为新一代的抗病毒药物。
同样,获得性免疫缺陷综合征(AIDS)病毒HIV有两种外壳糖蛋白,gp120和gp41。当病毒外壳蛋白在宿主细胞内复制时,由前体gp160在顺式高尔基体中经内切酶水解而成。当HIV感染细胞时,gp120和细胞表面的受体CD4结合,引起构象改变而使gp41暴露,后者再与细胞膜融合,使病毒进入细胞。当用NBDNJ处理感染HIV的细胞,使gp120的V1/V2环状区(gp120有5个恒区C和5个变区V)发生折叠异常,虽仍能和CD4结合,但不发生构象改变和gp41暴露,从而阻断病毒融合和入侵的过程。这是α葡萄糖苷酶抑制剂应用于抗病毒的又一范例。
2.2 N-糖链的识别功能在亚基聚合中的作用
寡聚体糖蛋白中的N-糖链能影响亚基的聚合。如免疫球蛋白IgG中Fc段CH2结构域的两条重链都在Asn297位有一条二天线N-糖链,其结构不同。通过一条糖链与对侧糖链或肽链中疏水位点的相互识别和作用,对维持Fc段两条重链的互相靠拢也有重要作用。人绒毛膜促性腺激素(hCG)由α,β 两个亚基组成,每一亚基各有两条结构不同的N-糖链, β亚基尚在121, 127, 132, 138位的4个Ser上各有一条O-糖链。单天线或二天线N-糖链和α,β 亚基的聚合有关。孕妇或滋养母细胞恶性肿瘤患者的尿中hCG 亚基的N-糖链有一部分转变成多(三、四)天线会阻止α和β亚基的聚合,使尿中出现hCG的α亚基单体。游离的α-亚基和完整hCG有不同的生理功能,前者能促进蜕膜细胞分泌催乳素,但不能促进性腺合成类固醇激素,后者则能刺激类固醇激素的合成而不影响催乳素的分泌。这说明人hCG中N-糖链的结构能影响α和β亚基的聚合并进而改变hCG的功能。
在基因工程中,如糖蛋白基因在缺乏糖化体系的大肠埃希菌中表达,常形成包涵体而很少分泌出细胞,其原因除糖链缺乏影响肽链的正常折叠和空间构象外,缺乏糖链引起蛋白质分子的疏水性聚合也可能是原因之一。这种无糖链的蛋白质药物往往是没有活性的。
2.3 N-糖链的识别功能对糖蛋白在细胞内分拣、投送和分泌中的作用
用衣霉素处理细胞以阻止蛋白质的N-糖化,可使很多定位于细胞膜上的糖蛋白减少,如转铁蛋白(transferrin)受体、胰岛素受体,整联蛋白(integrin)α亚基、HIV受体CD4等。其原因可能是:
①糖蛋白肽链折叠异常,暴露了肽链上的内质网滞留信号LysAspGluLeu,
②未糖化的蛋白质易受细胞内蛋白酶水解,
③即使正常折叠而未被水解的糖蛋白也可因糖链结构的改变而影响其投送或分泌,如N-乙酰氨基葡萄糖转移酶Ⅲ(GlcNAc TⅢ)本身是糖蛋白,在243,261和399位的3个Asn上都有N-糖化。用定点突变技术将3个Asn逐个突变成Gln,使该位点不能糖基化,发现Asn399位点上糖化的缺失较少影响酶活力,但使酶不能投送至高尔基体而滞留在内质网中;而243和261位的去糖化则既可引起酶活力的明显丧失,又导致酶在内质网上滞留,此结果和衣霉素处理一样。有时N糖链中个别糖基的改变也会影响糖蛋白的投送,如用Forskolin提高鼠肝癌细胞中的GlcNAc TⅢ,使某些糖蛋白(如γ谷氨酰转肽酶)上的平分型GlcNAc增加,也使其投送至细胞膜上减少。将GlcNAc TⅢ的基因转染小鼠,可发现小鼠有脂肪肝,但血清中β脂蛋白和前β脂蛋白反而减少。这是因为载脂蛋白B100的糖链上平分型GlcNAc增多后,使载脂蛋白B100不能合成β脂蛋白和前β脂蛋白而输出肝脏的缘故。
2.4 N糖链识别功能和激素的生物活性
腺垂体分泌的促卵泡激素(FSH) 和促黄体激素(LH)在N糖链末端结构上的差别是FSH含SAGal,而LH含HSO3GalNAc。已经证明: 带硫酸的LH和受体的亲和力较带SA的FSH高,但在体内的生物半寿期较短,在血中清除较快。这是因为肝脏网状内皮细胞上有一种凝集素样的受体,能特异地识别HSO3GalNAc结构,并结合LH而将其内吞清除;而以SA为糖链末端的FSH则必须经唾液酸酶水解掉SA而暴露内侧的Gal后,才会被某些细胞表面的“去唾液酸糖蛋白受体”(一种凝集素lectin)识别和内吞。
用化学法去除LH中α和β两个亚基的N糖链,再和正常有糖链的LHα,LHβ或FSHβ重组成αβ 二聚体,发现去糖基的LHα(DGLHα)和正常LHβ或DGLHβ重组后,对LH受体的亲和力较正常LHαLHβ二聚体明显增加,而对第二信使cAMP的生成量反而明显降低。DGLHβ和正常LHα重组后对受体的亲和力虽有所增高,但cAMP量的改变很小。如DGLHα和FSHβ重组,则对FSH受体的亲和力较正常LHαFSHβ二聚体增高更为显着,也使cAMP的生成量明显降低。可见LHα的N糖链能阻止LH与受体的结合,还参与LH的跨膜信号转导,抑制cAMP的生成。
以上例子证明体内的激素受体能识别激素的N糖链结构的改变而产生相应的不同效应。
蛋白类配体也能识别受体的N糖链结构。如大鼠卵巢LH/hCG受体有6个可能的N糖化位点,定点突变受体的Asn173成Gln而使173位去糖化后,受体不能再和LH或hCG结合,而突变Asn77和Asn152也可使高亲和力位点下降80%。
2.5 hEPO中N糖链的作用
基因工程药物的生产必须具备糖蛋白糖链的知识。如人促红细胞生成素(hEPO)含165个氨基酸残基,在24,38和83三个位点的Asn上各有一条N-糖链,在Ser126还有一条O-糖链。人尿中hEPO的N-糖链主要是四天线和C2C2,6三天线的酸性N糖链,但也有少量二天线N-糖链,80%有核心Fuc。 不同真核细胞中重组的hEPO(rhEPO)其糖链结构有所不同。其中CHO细胞表达的r-hEPO的糖链结构和人尿中天然hEPO最为接近。将r-hEPO中各个糖化位点的Asn突变成Gln,发现Asn38和Asn83,Ser126突变后,r-hEPO不能分泌到介质中,而只有Asn24突变的r-hEPO能分泌出来,但活性仅为天然hEPO的25%。用外切糖苷酶逐次切除糖链外侧的SA,Gal和GlcNAc后,发现其活力反而逐步增高,但切除五糖核心的Man后活性骤然下降,说明N糖链的五糖核心为hEPO活力所必需。有趣的是,hEPO的糖链结构对其体内活力的影响与体外截然不同,如切除SA后的r-hEPO注入体内后因很快被“去唾液酸糖蛋白受体”结合而清除,故几乎不表现活力。如再将末端Gal氧化,虽可延长体内半寿期,但仍无活力。虽然在体外含二天线N-糖链的hEPO较四天线糖链的hEPO活性高3倍,但含二天线酸性N-糖链的hEPO在体内的活力却远低于带四天线N-糖链的hEPO。四天线和二天线糖链的比值越高,体内活性也越强。有人认为四天线糖链的hEPO被肾脏滤过较慢或归巢至骨髓靶细胞较多,故在体内有较强的促红细胞生成的活性。
综上所述,可以认为:N-糖链末端的SA与hEPO的体内半寿期有关,天线的多少和肾脏排出率或定向转运至靶细胞有关,而五糖核心则可能参与hEPO空间构象的维持。不同N-糖链的hEPO在体内、外效力的不同主要也是受体识别N-糖链的结果。
2.6 O糖链的主要功能
必须指出:O-糖链也有某些类似N糖链的功能,诸如影响蛋白质亚基的聚合、生物半寿期和糖蛋白的分拣及投送等。因其重要性不及N-糖链,故不再重复,以下只介绍O-糖链的一些独有的功能。
细胞黏附也是一个分子识别问题。其中细胞表面整联蛋白家族和其配体纤连蛋白(fibronectin)之间的黏附可能和N糖链的关系较大;而选凝素(selectin,又称选择蛋白)对其配体Lewis抗原的识别作用则和O-糖链的关系较大,因Lewis 抗原在O-糖链上较多。Lewis抗原是另一类存在于细胞膜上的血型抗原,位于O-糖链(N-糖链也有)的外端,其基本结构由Galβ1→3/4GlcNAcα1→4/3Fuc组成,Gal末端还可被唾液酸化(表2),参与白细胞或血小板与血管内皮细胞的黏附,与白细胞在炎症浸润和癌细胞在转移时穿出血管有关。
选凝素有E,P,L 3种,分别存在于血管内皮细胞、血小板和淋巴细胞表面,能被选凝素识别和结合的糖链配体有很多种,但不同选凝素对同一配体的亲和力都不相同。共同配体中最典型的糖链结构是唾液酸化的Lewis X抗原(SLex) 和唾液酸化的Lewis A抗原(SLea) 以及它们的衍生物VIM2和双岩藻糖SLex(表2)。在这些结构中, α1,3或α1,4 Fuc基团是必需的。酸性配体(含SA或硫酸)对选凝素结合也是重要的,中性的Lex,Ley 和Lea,Leb不能和选凝素结合。有人已解析出E选凝素和Slex结合物的三维结构。
表2 3种选凝素对各种Lewis抗原衍生物的亲和力
配体名称结 构选凝素的亲和力L-E-P-SLexSAα2,3Galβ1,4(Fucα1,3)GlcNAcβ1-+++++VIM2SAα2,3Galβ1,4GlcNAcβ1,3Galβ1,4(Fucα1,3)GlcNAcβ1-+++/-双Fuc SLexSAα2,3Galβ1,4(Fucα1,3)GlcNAcβ1,3Galβ1,4(Fucα1,3)GlcNAcβ1-+++++SLeaSAα2,3Galβ1,3(Fucα1,4)GlcNAcβ1-+++++3硫酸LexHSO33Galβ1,4(Fucα1,3)GlcNAcβ1-++++3硫酸LeaHSO33Galβ1,3(Fucα1,4)GlcNAcβ1-++++ ++: 强结合 +: 弱结合 -: 不结合
哺乳动物的受精是卵巢排出的成熟卵子和已经获能的精子在输卵管内相遇而融合的过程。精子先和卵膜外层透明带中的糖蛋白结合而引发顶体反应。此过程包括精子头部细胞器顶体的外膜和精子细胞膜融合、释放顶体内容物,包括一些水解酶和糖结合蛋白,再形成囊泡后脱离精子。只有经过顶体反应的精子才能穿过透明带而与卵子细胞膜融合,使精子头部的细胞核进入卵子,完成受精过程。精卵结合具有高度的种属专一性。小鼠的透明带含有ZP1,ZP2和ZP3三种糖蛋白,含有较多的O糖链和N糖链。其中ZP3是在受精初期和精子结合而诱发顶体反应的主要糖蛋白,可认为是精子的受体。用内切糖苷酶切除N糖链后的外源性ZP3仍能抑制体内的精卵结合,提示没有N糖链的ZP3仍和天然完整的ZP3一样,也能和内源性的ZP3竞争地和卵子结合。但用稀碱去除OGalNAc糖链后的外源性ZP3就不能和内源性的ZP3竞争地和卵子结合,证明 ZP3通过 O糖链和精子蛋白质结合。精子头部表面和ZP3结合的蛋白质是一种分子量为5.6万的精子蛋白(SP56),在顶体反应时释放出来。这进一步证明精子SP56和卵子 ZP3中 O糖链末端的αGal结合是小鼠精卵结合的分子基础之一。现已证明这一带有αGal末端的结构是Galα1,3Gal,故有αGal末端的OGalNAc型糖链可阻断精卵结合而成为避孕药物。精子头部膜上的β1,4半乳糖转移酶(β1,4GalT)和α1,3岩藻糖转移酶(α1,3FucT)也可能介导精子和ZP3的结合,且精子头部的β1,4GalT和ZP3的结合可能是精卵结合的又一机制,而β1,4GalT可能与ZP3糖链末端的GlcNAc或GalNAc相结合。由此可见,生殖的分子机制也离不开糖链。
3 总结和展望
糖链的结构和功能已形成一门新的学科——糖生物学,其研究方兴未艾,越来越显示出它在生命科学中的重大意义。近年来,我们实验室还发现用糖基转移酶基因转染或剔除的方法改变细胞膜或细胞内糖蛋白糖链的结构,可引起细胞增殖速度、信号转导、基因表达、凋亡、迁移和侵袭能力等的变化,说明糖链可以调节很多细胞行为的强弱。基因合成蛋白质,包括糖基转移酶,后者合成糖链,蛋白质又介导细胞行为,而细胞行为和基因表达又受到糖链的调控。这就是三条大分子链的相生相克,是生命科学的辩证法。在实践应用上,糖链的研究促进了新一代抗病毒、抗感染、抗转移和计划生育等药物的开发。血液中糖蛋白糖链结构的测定可用于恶性肿瘤的诊断。异种器官移植也已从改变猪器官糖链抗原(末端的αGal糖基是引起速发性免疫排斥的关键分子)着手进行研究。今后糖生物学的发展将集中在糖复合物相关基因(glycogene)的克隆、糖蛋白组学(glycoproteomics)和糖组学(glycomics)的研究及其应用。人们将不再满足于探明糖复合物中每条糖链的功能,而更可能着眼于弄清糖链中每个糖基的功能。
【参考文献】
[1] 陈惠黎.糖复合物的结构和功能[M].上海:上海医科大学出版社,1997.
陈惠黎.糖蛋白的聚糖[M]∥陈惠黎.生物大分子的结构和功能.上海:上海医科大学出版社,1999:331-367.
陈惠黎.糖蛋白[M]∥王琳芳.医学分子生物学.北京:科学出版社,2002.
陈惠黎.糖蛋白糖链结构异常和恶性肿瘤的诊断[M]∥曹世龙.肿瘤学新理论与新技术.上海: 上海科技教育出版社,1997:20-52.
Rudd PM, Dwek RA.Glycosylation: Heterogeneity and 3D structure of proteins[M]∥ Farman GD.Critical review in biochemistry and molecular biology.Bo Co Roton:CRC press, 1997:1-100.
Brockhausen I, Schachter H.Glycosyltransferases involved in N and Oglycan biosynthesis[M]∥Gabius HJ, Gabius S.Glycosciences, Status and Perspectives.London,New York, Tokyo: Melbourne Madras:Chapman & Hall, 1997:79-112.
Kobata A.Structures and function of sugar chains of glycoproteins[J].Eur J Biochem,1992,209(2):483-501.
Dwek RA.Glycobiology: “toward understanding the function of sugars”[J].Biochem Soc Trans, 1995, 23(1):1-25.
Varki A.Acquired glycosylation changes in human disease[M]∥ Varki A.Essentials of glycobiology.New York: Cold Spring Harber Laboratory Press,1999:565-580.
[10] Chen HL, Guo P, Wang QY.Modification of cell growth, signaling and apoptosis by NacetylglucosaminyltransferaseV and 1,3fucosyltransferaseVII[J].Cur Drug Targets, In press.
[11] Chen HL.Lewis GlycoEpitopes: Structure, Biosynthesis and Functions[M]∥Albert M Wu.The molecular immunology of complex carbohagrate 3.New Yark, Boston, Dordrecht,London,Moscow: Kluwer Academic/Plenum Publisher,In press.
相关阅读:
- 高精度质谱数据的MS2母离子归属问题 (mass, 2011-8-20)
- AB SCIEX欢迎蛋白质组学者们参加第10届HUPO会议的技术交流会 (release, 2011-9-03)
- HUPO 2011:AB SCIEX研讨会上启动新的人类蛋白质组计划 (release, 2011-9-15)
- Aebersold_MSB_微生物不同形态下蛋白质组的绝对定量 (release, 2011-9-16)
- 基于质谱技术蛋白质定量方法的研究进展 (dingdang, 2011-9-16)
- HUPO见闻:SWATH对DDA将产生巨大冲击 (release, 2011-9-21)
- 质谱沙龙第三十三期活动报道 (sclbj, 2011-9-28)
- 我科学家成功绘制人类肝脏蛋白质相互作用网络连锁图 (snwxf, 2011-10-17)