寨卡疫情紧急状态解除,且看2017寨卡病毒研发管线
自2015年5月巴西发现首例本地感染寨卡病毒病例以来,寨卡疫情不断发酵,开始在巴西等美洲国家持续肆虐,对疫情地区带来了一定的恐慌。寨卡病毒主要通过蚊虫传播,还可经性交传染,多数感染者不会发病,但是偶尔会出现发烧、红疹、关节疼痛等轻微病状。其对人类的威胁主要在于孕妇一旦感染寨卡病毒,可能导致胎儿发育异常,出现小头症等畸形。
针对寨卡病毒,目前尚无有效的治疗方法和疫苗。本月18日世界卫生组织(WHO)宣布,寨卡病毒及其所引发的神经系统疾病仍是一个显著持续的公共卫生问题,但是已不再是“国际关注的突发公共卫生事件”,世界卫生组织将以长期应对机制来对抗这种病毒。
世界卫生组织负责人称将寨卡病毒持续传播,埃及伊蚊流行的国家都面临病毒传播的风险,解除寨卡疫情紧急状态并非轻视寨卡疫情,而是将其作为一项长期的工作。WHO强调对某些地区而言,寨卡病毒仍然是一个很大的威胁。现在该组织将创建一个负责寨卡病毒研究的技术委员会,不断向前推进寨卡病毒的研究、寨卡疫苗的研制及其他一些项目。
很多致力于研究对抗寨卡病毒的机构表示,不会因WHO这一决定的影响而改变对项目的继续支持。且让我们看一下有望在对抗寨卡病毒的疫苗研发中取得突破的研究组织,它们势必将会在2017年寨卡疫苗研发管线中扮演着重要角色。
NHI(美国国立卫生组织)
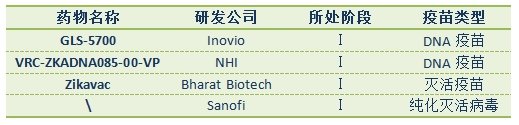
NHI下属的国家过敏症和传染病研究所(NIAID)研发的寨卡疫苗已进入临床试验阶段,这种称之为VRC-ZKADNA085-00-VP的疫苗是一种DNA(脱氧核糖核酸)疫苗。这种疫苗含有一段来自寨卡病毒的DNA合成片段,疫苗注射到肌肉细胞之后,细胞内会产生寨卡病毒蛋白质,进而分泌出很多类似寨卡病毒的小粒子,这些粒子能刺激机体免疫系统产生免疫反应,从而达到预防寨卡病毒感染的目的。这种DNA疫苗于今年8月3日由美国FDA批准进入临床试验,预计将于一月份得到I期临床试验安全性和免疫原性数据。
美国生物技术公司Inovio Pharmaceuticals
NHI在对抗寨卡病毒的疫苗研发上稍微落后于美国生物技术公司Inovio Pharmaceuticals一步。Inovio与韩国生物医药公司GeneOne合作开展寨卡疫苗研发,这也是双方继去年联合开发中东呼吸综合征(MERS)疫苗之后的第二次合作。针对对抗寨卡病毒的DNA疫苗GLS-5700,早在6月份已在美国3个地方开始对40名健康成年人进行人体试验,通过专有的DNA传递设备对这些志愿者接种疫苗之后,科研人员将对GLS-5700的安全性、耐受性和免疫原性展开探讨。Inovio很快又在Puerto Rico招募80位患者再次开展临床试验。
GLS-5700是首度通过 FDA审批进行人体试验的疫苗,在此前的动物实验中,这种疫苗已显示出令人欣喜的效果。Inovio披露GLS-5700的研发人员也曾经参与埃博拉病毒疫苗的研发,对黄病毒疫苗研发由一定的经验。业内人员预测Inovio很有可能成为首家推出寨卡疫苗的公司。
美国生物技术公司Inovio Pharmaceuticals
NHI在对抗寨卡病毒的疫苗研发上稍微落后于美国生物技术公司Inovio Pharmaceuticals一步。Inovio与韩国生物医药公司GeneOne合作开展寨卡疫苗研发,这也是双方继去年联合开发中东呼吸综合征(MERS)疫苗之后的第二次合作。针对对抗寨卡病毒的DNA疫苗GLS-5700,早在6月份已在美国3个地方开始对40名健康成年人进行人体试验,通过专有的DNA传递设备对这些志愿者接种疫苗之后,科研人员将对GLS-5700的安全性、耐受性和免疫原性展开探讨。Inovio很快又在Puerto Rico招募80位患者再次开展临床试验。
GLS-5700是首度通过 FDA审批进行人体试验的疫苗,在此前的动物实验中,这种疫苗已显示出令人欣喜的效果。Inovio披露GLS-5700的研发人员也曾经参与埃博拉病毒疫苗的研发,对黄病毒疫苗研发由一定的经验。业内人员预测Inovio很有可能成为首家推出寨卡疫苗的公司。
法国制药巨头Sanofi(赛诺菲)
进入寨卡病毒疫苗领域一展拳脚的玩家也包括疫苗领域大佬级玩家,诸如法国制药巨头赛诺菲(Sanofi)、葛兰素史克(GSK)等。赛诺菲在研制黄病毒属病毒疫苗方面处于世界领先水平,已成功研制出登革热疫苗,并在一些国家开始使用。其中寨卡病毒与登革病毒相近,两者皆属于黄病毒属,其疫苗研发经验将为寨卡疫苗的研发提供思路。7月赛诺菲与美国沃尔特里德陆军研究所(WRAIR)达成一项协议,共同开发寨卡病毒候选疫苗。协议商定,WRAIR把寨卡纯化灭活病毒(ZPIV)疫苗技术转交给赛诺菲巴斯德,该疫苗将于秋季进入临床初级试验。
美国生物技术公司Inovio Pharmaceuticals
NHI在对抗寨卡病毒的疫苗研发上稍微落后于美国生物技术公司Inovio Pharmaceuticals一步。Inovio与韩国生物医药公司GeneOne合作开展寨卡疫苗研发,这也是双方继去年联合开发中东呼吸综合征(MERS)疫苗之后的第二次合作。针对对抗寨卡病毒的DNA疫苗GLS-5700,早在6月份已在美国3个地方开始对40名健康成年人进行人体试验,通过专有的DNA传递设备对这些志愿者接种疫苗之后,科研人员将对GLS-5700的安全性、耐受性和免疫原性展开探讨。Inovio很快又在Puerto Rico招募80位患者再次开展临床试验。
GLS-5700是首度通过 FDA审批进行人体试验的疫苗,在此前的动物实验中,这种疫苗已显示出令人欣喜的效果。Inovio披露GLS-5700的研发人员也曾经参与埃博拉病毒疫苗的研发,对黄病毒疫苗研发由一定的经验。业内人员预测Inovio很有可能成为首家推出寨卡疫苗的公司。
印度生物技术公司Bharat Biotech
在寨卡病毒研发方面处于领先地位的公司包括Bharat Biotech,它是一家位于印度南部城市海得拉巴的生物技术公司,专门从事于疫苗和生物药品的生产。该公司于今年2月份宣布了第一个寨卡病毒候选疫苗Zikavac,WHO已经认可了该公司的成绩,并希望能够尽快开展试验。
日本医药巨头武田药业(Takeda)
此外还有一些制药公司涉足寨卡疫苗研发,如日本医药巨头武田药业(Takeda),它是一家在传染病疫苗研究领域久负盛名的老牌生物医药公司,曾成功完成登革热、诺瓦克病毒等传染病疫苗的开发。9月初,美国政府下属的公共卫生部门生物医学高级研究与发展管理局(BARDA)与武田药业达成协议,共同开发寨卡病毒疫苗。按照双方达成的协议,BARDA将先支付武田1980万美元,以支持后者完成疫苗的Ⅰ期临床研究。如果试验进展顺利,将再支付3亿多美元用于疫苗后续研发。
美国疫苗生产商PaxVax
美国疫苗生产商PaxVax的霍乱疫苗Vaxchora于今年6月份得到了美国FDA批准上市许可,成为首个由美国FDA批准上市的霍乱疫苗。10月份PaxVax宣布了Vaxchora的可使用性,为前往受霍乱影响地区的美国市民提供了一种保护。继在霍乱疫苗方面取得的巨大成功之后,PaxVax 3月份曾告诉PharmExec杂志,该公司正在采用先进的来自登革热研究的专有技术研发寨卡疫苗,目前疫苗研制处于初期阶段。
正如预期的那样,寨卡病毒继续蔓延在世界各地,并在60多个国家和地区传播。小头畸形等神经系统并发症相关的病毒已经在至少28个国家有所报告。很多研究机构针对寨卡病毒已完成不少早期实验室研究,也得到了欣慰的研究数据,相关研究成果为其疫苗研发提供了很大的支持。几种疫苗也已经进入早期临床试验,又有多种疫苗处于早期研发阶段。但是疫苗研发本身是一个漫长曲折的过程,期间充满了太多的不确定性,疫苗的研发需要全球研究机构的通力合作。
-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐
 询底价 Tel:400-6699-117 转 6209
询底价 Tel:400-6699-117 转 6209 -
焦点事件

-
焦点事件

-
项目成果