dGTP激活SAMHD1四聚体结构机制研究获进展
近日,国际期刊Nature Communications发表了中科院高能物理研究所多学科中心蛋白质结构中心龚勇研究员与天津大学生科院于晓方教授合作完成的研究成果——dGTP激活SAMHD1四聚体的结构机制研究(Structural insight into dGTP-dependent activation of tetrameric SAMHD1 deoxynucleoside triphosphate triphosphohydrolase)。
SAMHD1是近年来新发现的抑制爱滋病毒(HIV)的人源蛋白质分子。Nature杂志在2011年同期发表了两篇论文,证明了SAMHD1是一个新的病毒抑制因子。SAMHD1具有dNTPase活性,有可能通过降解反转录病毒复制所需要的原料dNTP,在某些细胞内阻断HIV的复制。目前这一蛋白质分子已经成为HIV研究领域的新热点。
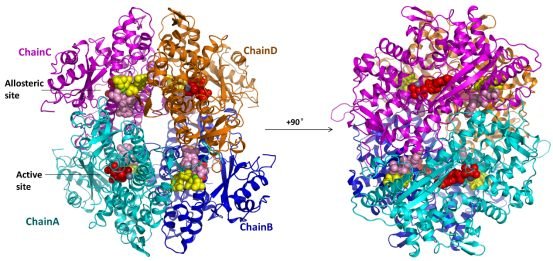
最新发表的Nature Communications论文报告了高达1.8埃分辨率的SAMHD1同源四聚体晶体结构,高分辨率的晶体结构清晰地说明了dNTP是如何通过变构位点将四个分子黏合在一起,并且使酶活中心构象发生改变,导致底物分子的结合更加稳定。另外生化实验证明,变构位点的结合氨基酸突变会影响四聚体形成、dNTPase酶活性和对HIV-1的限制能力。
为了捕捉到SAMHD1同源四聚体的结构,需要在结晶条件中加入高浓度的dNTP分子,而且必须在晶体出现之后的24小时之内收集晶体衍射数据,否则dNTP会被持续降解,36小时之后晶体分辨率将急剧降低。借助于北京同步辐射装置的便利条件,该课题才能顺利得到所需的结构数据。这个例子显示出立足于同步辐射装置开展前沿结构生物学研究的优势。
天津大学生科院院长、“千人计划”于晓方教授和高能所多学科中心龚勇研究员是论文的共同通讯作者。
图:SAMHD1同源四聚体的晶体结构。位于活性位点的底物分子和Zn离子显示为红色和灰色,位于变构位点的两个dNTP分子和Mg离子分别显示为黄色,粉色和绿色