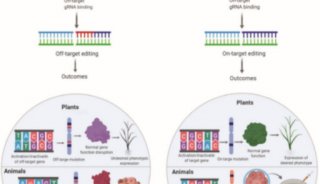
基因编辑新进展: 关键酶消除CRISPR-Cas技术脱靶效应
近来全球兴起的CRISPR-Cas编辑技术是基于细菌和古细菌天然防御机制的一项技术。与真核生物体内的RNA干扰过程极为相似,CRISPR-Cas 技术能够特异性切割核酸片段,不过该技术也有可能发生非特异性切割,引起基因组非靶向位点的突变,这一问题越来越受到科研人员的关注。
CRISPR-Cas系统的脱靶效应
哈佛医学院的George Church及同事们比较了CRISPR-Cas系统,与以转录激活因子样效应子(TALEs)为基础的另一种基因表编辑工具在人类细胞中的靶向特异性。重要的是,Church研究小组还提出了一种新方法减少了利用CRISPR-Cas时的潜在脱靶效应。研究成果发表在8月1日《自然生物技术》(Nature Biotechnology)杂志上。
CRISPR-Cas系统是通过将短链外源遗传物质整合到宿主基因组中来发挥作用的。这些序列被转录并加工成小RNAs,随后小RNAs可与Cas蛋白复合物一起结合与小RNA序列相匹配的外源DNA或RNA,从而导致入侵核酸遭到序列特异性地切割和破坏。
在新研究中,Church和他的研究团队发现,TAL效应子容许靶序列1-2个碱基对错配;由单导向RNA(single-guide RNA)和Cas9蛋白构成的复合物能够容许1-3个碱基对错配。“这不是一个大问题,但它却可能会导致一些脱靶效应,”洛克菲勒大学CRISPR干扰专家Luciano Marraffini说。
如何解决CRISPR-Cas系统脱靶
为了解决这一问题,Church研究小组生成了一系列的Cas9突变体,这些Cas9突变体没有生成双链断裂,而是引入了偏移缺口,每个缺口只影响一条 DNA链。尽管这一策略实质上造成了双链断裂,它通常不会导致非同源末端连接(双链断裂的一种细胞修复机制)引起的插入或删除。因此,这种方法可能会减少脱靶效应。
利用核酸酶系统重新构建基因组并非全新的研究。研究人员过去也曾为了减少脱靶效应,而制造出了另一种基于锌指核酸酶的基因组编辑工具。今年早些时候,Marraffini和他的合作者们报告称,可将Cas9转换为一种切口酶,减少与DNA修复机制相关的脱靶突变。
然而,Church的方法是否确实能减少脱靶效应仍有待证明。Sangamo BioSciences公司首席科学官Philip Gregor 说:“Church朝着解决这一问题迈出了第一步。但本文没有对这一切口诱导双链DNA切割方法的特异性进行评估。解决这一特异性问题非常的重要。”
Sangamo 公司当前正在开展临床试验,评估用锌指核酸酶来治疗HIV/AIDs。尽管Church指出相比于锌指核酸酶和TAL效应子,CRISPR-Cas系统要容易100-1000倍,但Gregory仍有所怀疑。“至少以它当前的形式,CRISPR-Cas9系统极易发生重要的脱靶活性,其可能超过期望目标位点的切割水平,”Gregory说。
尽管存在这些担忧,Church的研究还是让科学团体产生了一些乐观的看法。“到目前为止已经证实CRISPR-Cas9具有较差的基因组编辑特异性,尽管高效,它走向了垃圾场。这一双切口方法及时地停住了垃圾车。”
专家点评CRISPR/Cas技术
上世纪80年代初,科学家们用显微注射的方法将外源DNA片段导入小鼠受精卵的原核中,构建出了第一个转基因小鼠。至今原核显微注射仍然是制备转基因动物的最常用的方法。然而该方法只能将外源DNA片段导入动物基因组中,无法对体内基因组的特定序列进行特定的修饰。80年代后期,由于小鼠ES细胞及同源重组技术的发展而催生的基因打靶技术使得科学家们可以对小鼠的任何基因序列进行随意的修饰,基因打靶技术的发展使生命科学的研究发生了革命性的改变,但用此技术制备基因工程动物模型花费较大,过程较长,而且由于基因的修饰是在ES细胞中进行,目前用基因打靶技术只能用于制备基因改变的小鼠和大鼠动物模型。
近几年,生物学家们发现,两种人工改造过的核酸酶ZFN和TALEN能够识别并结合指定的基因序列位点,并高效精确地切断。随后细胞利用天然的DNA修复过程来实现DNA的插入、删除和修改,这样研究人员就能够随心所欲地进行基因组编辑。ZFN和TALEN技术结合了原核注射的制备周期短和基因打靶技术的定点修饰的特点,而且可以应用到除小鼠和大鼠之外的其他动物。但其脱靶效应(off target),也就是把不该切的地方切了的问题仍是一个挑战。
今年初以来,一种新的基因组修饰的技术CRISPR/Cas 受到人们的高度重视。 CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats)是细菌用来抵御病毒侵袭/躲避哺乳动物免疫反应的基因系统。科学家们利用RNA引导Cas9核酸酶可在多种细胞(包括iPS)的特定的基因组位点上进行切割,修饰。 Rudolf Jaenisch 研究组将Cas9与Te1和Tet2特异的sgRNA共注射到小鼠的受精卵中,成功得到双基因敲除的纯合子小鼠,效率高达80%。 他们将Cas9/sgRNA 与带突变序列的引物共注射,能准确在小鼠两个基因引入所要的点突变。在ES细胞中他们更是成功的一次敲除了五个基因。与ZFN/TALEN相比,CRISPR/Cas更易于操作,效率更高,更容易得到纯合子突变体,而且可以在不同的位点同时引入多个突变。但该系统是否有脱靶效应尚需进一步的研究。
传统的转基因和基因打靶技术,由于技术稳定成熟,可以对小鼠和大鼠的基因组序列进行各种修饰,目前仍将是模式动物的构建的主要技术。 核酸酶ZFN/TALEN 尤其是CRISPR/Cas技术如果能解决脱靶效应的话,有可能会广泛应用于小鼠,大鼠及其他模式动物的制备和研究中,成为传统的转基因和基因打靶技术的重要补充。
-
科技前沿
-
项目成果
-
项目成果
-
项目成果