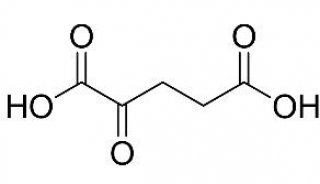
中国医学科学院发现一种新型小分子TNFα抑制剂
2014年3月14日,中国医学科学院、哈佛大学医学院、波士顿儿童医院和伊利诺伊大学香槟分校的研究人员,在《Journal of Biological Chemistry》杂志发表的一项研究中,利用计算机辅助药物设计结合体外和细胞试验,发现了一种小分子化合物(称为C87),这种化合物能直接靶定TNFα,有效地抑制TNFα诱导的细胞毒性,并有效地阻断TNFα触发的信号活动。此外,利用小鼠急性肝炎模型,C87可减轻TNFα诱导的炎性反应,从而显著降低对肝脏的损伤,提高动物的存活率。
本文的通讯作者是中国医学科学院北京协和医院实验血液学国家重点实验室的周家喜和许元富。该研究受到国家基础研究计划、国家自然科学基金和天津自然科学基金的资助。
肿瘤坏死因子α(TNFα),主要由激活型单核细胞/巨噬细胞分泌,是一种多效性细胞因子,在宿主免疫系统中发挥至关重要的作用。TNFα诱导的信号传递,已被证实能调节多种细胞功能,包括生存、增殖和细胞死亡。TNFα信号通过两种不同的受体介导,分别是TNFR1 (p55)和TNFR2 (p75)。人们普遍认为,TNFR1介导大多数TNFα活动,因为它在大多数组织中持续表达。相反,TNFR2通常出现在免疫细胞内。TNFα的血清水平升高,能引起多种炎症性疾病,例如风湿性关节炎、炎症性肠疾病、感染性休克、多发性硬化症和肝炎
由于TNFα在炎症性疾病中产生的深远影响,因此,直接抑制TNFα就成为这类疾病治疗的主要策略。靶定TNFα及其信号传导元件的生物制剂的发展,已经取得了重大进步。有几种知名的商业TNFα抑制剂,如英夫利昔(infliximab)、阿达木单抗(adalimumab)和依那西普(etanercept),所有这些药物都是TNFα抗体或TNFR1-Fc嵌合体,用来阻止TNFα与受体的结合。
到目前为止,已有研究证明,由于其独特的优势例如高特异性,这些生物大分子药物能有效治疗炎症性肠疾病和风湿性关节炎。然而,也存在一些严重的局限性,例如稳定性差、无效成本的商业规模生产和血脑屏障排斥。相反,小分子化合物能够克服大分子抑制剂的大多数缺点,因此已被视为是适当的替代品。此外,它们还具有其他的临床优势,例如较简单的口服给药。
到目前为止,通过利用计算机辅助药物设计(computer-aided drug design,CADD)和基于细胞的体外试验,研究人员已经确定了一些选择性的小分子TNFα活性拮抗剂。
虽然这些小分子抑制剂能在体外阻断TNFα的生物活性,但很少有人证明,它们能够在体内废除或减少TNFα诱导的炎症反应,且表现较高的IC50和严重副作用。同时,没有报道称,哪一种小分子抑制剂能够在体内直接结合TNFα,成功地阻断TNFα与TNFR的相互作用。因此,研制TNFα疗法小分子仍然是一个重大的挑战。
目前,TNFβ/TNFR1复合物的晶体结构,仍然是分析TNFR1及其配体关键互动位点唯一可用的可靠模板。因此,这种结构已被用作合理设计TNF抑制剂的基础。TNFα和TNFβ都属于TNF超家族,尽管它们具有低的序列同源性,但它们共有惊人相似的三维结构,因此可以利用CADD平台来设计小分子,阻断TNFα及其同源受体之间的相互作用。实际上,已有研究人员成功研制了短肽,可模拟TNFR1的loop1/domain3,能够阻断TNFα信号传递。然而,尽管这些短肽具有活性,它们对于商业化生产和体内抑制TNFα的临床应用,还有一定的局限性。
在这项研究中,为了探索对抗TNFα活性的化学抑制剂,研究人员通过虚拟筛选结合体内和体外试验,发现了一种新型TNFα化学抑制剂,命名为C87。他们发现,C87能够直接结合TNFα,有效地抑制TNFα诱导的细胞毒性,并有效地阻断TNFα触发的信号活动。此外,更重要的是,通过利用小鼠急性肝炎模型,研究人员发现,C87可在体内减轻TNFα诱导的炎症反应,从而显著降低对肝脏的损伤,并提高动物的存活率。因此,这些研究结果可带来一种新型和高度特异性的小分子TNFα抑制剂,潜在地用于治疗TNFα介导的炎症性疾病。