不同寻常的转运因子作用
来自中山大学公共卫生学院,附属第一医院等处的研究人员发表了题为“Retinol Binding Protein-Dependent Cholesterol Uptake Regulates Macrophage Foam Cell Formation and Promotes Atherosclerosis”的文章,揭示了RBP4的促动脉粥样硬化作用,同时也指出了这一关键因子对除糖尿病以外更多疾病的影响。
这一研究成果公布在心血管领域顶级期刊 《Circulation》(IF19.309)上,文章的通讯作者是中山大学公共卫生学院夏敏教授,夏教授长期从事营养膳食预防动脉粥样硬化(Atherosclerosis, AS)性心血管疾病的基础研究,以糖脂代谢紊乱损伤血管内皮为切入点,围绕AS发病的营养代谢机制等方面展开了多项研究,也取得了不少重要的成果。
视黄醇结合蛋白(Rgtinol-BindingProteim,RBP)是血液中维生素A(又称视黄醇Retinol)的转运蛋白,其中RBP4是一种新的脂肪因子,主要由肝脏和脂肪组织分泌,在循环中负责运送视黄醇(维生素A)至靶组织,越来越多的研究表明RBP4参与了胰岛素抵抗,2型糖尿病,以及血管并发症的发生,并且RBP4表达水平增高也与心血管疾病风险增加密切相关,然而关于RBP4在动脉粥样硬化疾病中的精确作用,以及其作用机制,至今仍是不解之谜。
动脉粥样硬化是冠心病及缺血性脑血管病发生的主要原因。随着人们生活方式的改变,尤其是高脂饮食,动脉粥样硬化的发病率显著上升,由此而导致的死亡率也逐年增加。这种疾病的一大特征在于巨噬细胞泡沫化,形成巨噬细胞来源的泡沫细胞,氧化低密度脂蛋白(oxLDL)增加,同时胆固醇流出量减少,从而导致酯化胆固醇在巨噬细胞细胞质中沉积。在巨噬细胞中,oxLDL可以通过几种清道夫受体(Scavenger receptors)吸收,比如A类SR(SR-AI,SR-AII,SR-AIII)和B类SR(SR-BI,SR-BII,CD36),这些都是重要的模式识别受体,在这里SR-A和CD36起主要的作用。之后oxLDL来源的胆固醇通过SRs进入巨噬细胞,并通过乙酰辅酶A:cholesterol acyltransferase-1酯化,作为脂滴储存下来。如果脂质积累过多,巨噬细胞也能通过ABC转运蛋白ABCA1和ABCG1,促进脂质流出。如果这些步骤中任何有一个出现问题,巨噬细胞中的脂质平衡就会发生紊乱,最终就有可能导致动脉粥样硬化的发生。
为了阐明RBP4在动脉粥样硬化中所起的作用,揭示其作用机制,夏敏教授研究组进行了多方面的尝试,他们首先在一个包括华南地区1683位参与者的前瞻性群组研究中分析了血清中RBP4水平与心血管事件发生率之间的关联,结果指出血清RBP4的表达水平可以作为心血管事件(经传统风险因子调整后)的独立预测因子。
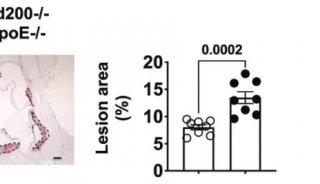
但这不足以说明问题,为此接下来,研究人员设计了新的小鼠模型,通过赛业生物获得了人源RBP4表达转基因小鼠(RBP4-Tg),分析了RBP4的增多和缺失对巨噬细胞泡沫细胞形成过程,以及动脉粥样硬化的影响。研究人员指出RBP4定位在富含巨噬细胞泡沫细胞的区域,如果加入外源的重组RBP4,或者令RBP4基因过表达,那么就能促进巨噬细胞来源的泡沫细胞形成,这个过程是通过清道夫受体CD36介导的胆固醇吸收激活实现的。而且通过这一转基因模型,研究人员还发现RBP4能利用JNK途径,以及STAT1,增加CD36的表达,同时RBP4也改变了酪氨酸激酶c-Src的膜分布,令后者被分配到了脂质膜亚结构域上。此后研究人员也通过细胞系等分析了RBP4在泡沫细胞形成过程中的作用。
这些研究都揭示了RBP4的促动脉粥样硬化作用:RBP4通过诱导巨噬细胞来源的泡沫细胞形成促进动脉粥样硬化,这有助于扩展目前我们对这一分子的认识——它的作用不仅仅是作为糖尿病的标识。
-
技术原理