Nature子刊:测定改性蛋白质的新方法
最近,瑞士的研究人员开发出一种新方法,来测量结构发生改变的蛋白质。这有望使研究人员开发出新的诊断工具,对神经退行性疾病进行早期识别和发现。相关研究结果发表在最近的《Nature Biotechnology》杂志。
细胞通过各种各样的方式调节蛋白质的功能,包括通过修改蛋白质的结构。蛋白质可在一瞬间呈现另一种形式,不执行功能,甚至执行“错误”的功能:在人类中,折叠错误的蛋白质会导致严重的疾病,如阿尔茨海默氏症、帕金森氏综合症和囊胞性纤维症。这些蛋白质有一些也易于“感染”其他同类型的分子,并聚集成不溶性的所谓淀粉样纤维或斑块。这些淀粉样蛋白会伤害细胞和组织,使人得病。
打破束缚的方法
直到现在,一直都缺乏相应的方法,来定量记录复杂生物样品中的结构改性蛋白质。虽然有一系列的技术可研究结构改变的蛋白质,如X射线晶体学、核磁共振光谱学和其他光谱技术,但是它们都不能用来分析复杂的生物样品。研究人员用于研究细胞中蛋白质结构变化的其他程序也有其局限性:在分析之前,必须特别地标记感兴趣的蛋白质,以使科学家们能够在样品中观察它们。然而,这种方法仅对一个样本中的一些蛋白质是可能的。
现在,由苏黎世联邦理工学院(ETH)蛋白质网络生物学教授Paola Picotti带领的研究小组,找到一种方法来测量任何生物样品中的结构改性蛋白质,其中可以包含数千种不同的蛋白质。Picotti和她的研究小组已经成功地测量了直接来自于复杂蛋白质混合物的大量结构改性蛋白质(发生在细胞中),而不需要清洗或浓缩样品。
几种方法的组合
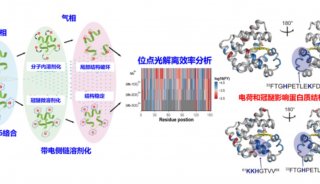
为了开发新的方法,研究人员将一种“老”技术与蛋白质组研究的一种现代方法相结合。首先,将常用的消化酶(如蛋白酶K)添加到样品中,这种酶可根据蛋白质结构,将蛋白质切断为更小的碎片,称为肽类。然后,使用一种技术(这项技术是 Picotti在苏黎世联邦理工大学从事博士后研究期间共同开发)测量这些片段。这种方法被称为选择反应监测(Selected Reaction Monitoring,SRM),可使研究人员寻找许多不同的肽段并测量它们的数量。根据所发现的肽类,可以确定和量化最初存在于样品中的蛋白质。
是什么让它如此特别:消化酶可切断在不同地方具有不同结构的同种蛋白质,从而产生不同的片段。就像指纹一样,这些片段可被很清楚地分配到蛋白质的单个结构中。
Picotti称:“这意味着,我们可以用这种方法,以一种靶定的方式,来分析特定蛋白质或整个蛋白质网络的结构变化,并同时检测大量蛋白质。”
引起帕金森症的蛋白质
基于这种新方法,研究人员设计了一个实验来专门测量复杂的、未纯化样品(如血液或脑脊液)中“健康”和“生病”版本的α突触核蛋白。α突触核蛋白,当其结构发生改变的时候,被认为可导致帕金森症。病理结构变化与其同类聚集形成淀粉样纤维,可损害神经细胞。
借助于实验,科学家们能够直接测量复杂样品中的致病性和非致病性α突触核蛋白的确切数量。该试验还产生了蛋白质结构的信息。Picotti称:“它向我们展示了蛋白质的哪一部分发生了改变并变成新的病理结构。”
越来越多的淀粉样变性
随着时间的推移,α突触核蛋白的浓度无法作为生物标志物,因为帕金森症患者和正常人血液或脑脊液中的蛋白质水平太过相似。Picotti教授称:“然而,致病性和非致病性α突触核蛋白结构的比值,很有可能会随着时间变化及疾病的进展而发生变化。因为这种新方法可使我们能够测量各种各样样品中α突触核蛋白的两种结构,那么将来我们可以用它来开发这种疾病的新生物标志物。”使用这种方法也有可能发现其他的、至今仍未知的淀粉样蛋白,根据先前知识它们与疾病有关。
Picotti指出,从药用角度来看,这两种应用——定量特定的、已知的结构改性蛋白质和发现具有不同结构的蛋白质——是高度相关的。她说:“淀粉样变性的数量,即因蛋白质结构变化而引发的疾病,每年都在增加。”
-
焦点事件

-
项目成果
-
科技前沿

-
项目成果
-
焦点事件

-
企业风采


















