Bruker公司MALDI Biotyper CA第二批扩展项目获得FDA 510(k)批准
美国时间4月6日上午,Bruker公司发表声明,旗下在美销售的应用于临床微生物研究的MALDI Biotyper CA系统在数据库与方法扩展项目上获得了美国FDA 510(k)的正式批准函。
早在2013年11月,Bruker公司的MALDI Biotyper CA系统(一种体外诊断解决方案)的首批项目就获得了FDA 510(k)的批准,包括了业界领先的MALDI Biotyper设备、软件、囊括了40种需氧革兰氏阴性细菌及菌群的数据库(包含了100种临床相关物种)、活体诊疗试剂及工作化流程。
此番获批的扩展项目增加了180种临床相关物种,包括需氧革兰氏阳性菌、厌氧革兰氏阴性菌、肠杆菌科、厌氧细菌及酵母。除此之外,新增的样品处理方法能够进一步优化实验流程。
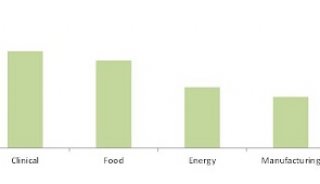
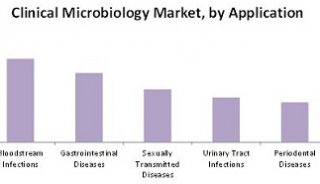
截至目前,获得510(k)批准的MALDI Biotyper CA体系可以鉴定总计280种临床相关细菌及酵母,覆盖了98%以上的典型临床微生物学鉴定流程。
作为后续临床试验的一部分,Bruker公司向FDA提交了10000多组谱图数据。这些由MALDI Biotyper CA系统得到的结果,在细菌鉴定与酵母鉴定上分别与16s rRNA分子测序及ITS测序的结果进行了比对。结果显示,该系统下98.9%的检测可以实现正确的物种鉴定,只有0.9%的情况无法实现正确鉴定。这是目前利用质谱技术对细菌及酵母进行鉴定所能达到的最高准确率。
Bruker公司总裁兼首席执行官Frank H. Laukien博士表示,“MALDI Biotyper在全球范围内已经改变了细菌鉴定的模式,它带来了快速的实时检测、卓越的鉴定性能、简单的操作性、合理的价位及耐用紧凑的仪器设备。此次获得510(k)批准的项目进一步扩展了该系统对于细菌及酵母准确鉴定的应用范围,将提供该领域最大的FDA认证的数据库。这为美国中等以上规模的医院及临床微生物研究机构提供了全新的技术手段,使它们能够为传染性疾病患者带去更为先进的技术服务以及全新的护理标准。”
MALDI BioTyper CA报告中的某些鉴定结果是非临床性的。这些结果只是应用在公众健康领域,为后续相关实验检测提供参考。
-
焦点事件
-
焦点事件

-
焦点事件