查看完整版本请点击这里:
【讨论帖】Ni柱纯化蛋白结果,敬请批评。
【讨论帖】Ni柱纯化蛋白结果,敬请批评。
这是我第一次用Ni柱纯化的蛋白SDS-PAGE结果:左侧是分子量标记,右侧最亮的条带是目的蛋白,但是还有不少的杂蛋白污染。不知这样的结果怎么样?是不是分离纯度太低,需要改进?我分离蛋白采用的是细菌包涵体变性裂解方法。主要的目的是纯化蛋白制备单抗。采用的NI是NOVAGEN(NI-NTA HIs bind Resins)产品。步骤完全照说明书进行。
查看完整版本请点击这里:
【讨论帖】Ni柱纯化蛋白结果,敬请批评。
【讨论帖】Ni柱纯化蛋白结果,敬请批评。
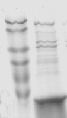
26715733.jpg



最新回复
moonlight45 (2013-5-13 16:53:36)
增加washing buffer 的量,延长洗涤时间或增加咪唑浓度。
finger (2013-5-13 16:54:07)
我给你发了份相关的材料,包括不同金属粒子的选择性和分离效果,只在做试验的时候把一般的缓冲液换成8M脲或者6M盐酸胍即可,以前也遇到有人问这个问题,它参照这个材料的方法就没事了,其实纯化没有那么简单,照规程一定能做好的,我们最近经常做带his标签蛋白纯化,无论是包涵体还是别的都没有问题。
fei1226com (2013-5-13 16:54:36)
Ni柱纯化少量目的蛋白,已经进行了两次都含有很多杂带,想问问有那些原因?
summerxx (2013-5-13 16:55:46)
你可以在后面增加一步离子交换能达到不错的效果
orangecake (2013-5-13 16:56:09)
IAM007 (2013-5-13 16:56:28)
虽然你用的Ni柱是亲和纯化,但是并不是说亲和纯化一步就能得到非常纯的蛋白,一般都要加一些其它的分离纯化步骤,想你这样的结果,只通过改变Ni柱的分离纯华条件可能很难有大的突破.你可以根据你的蛋白的等电点增加DEAE或是sp柱子,或者考虑别的柱子!祝你成功!
ero11 (2013-5-13 16:56:49)
其实分离的好坏关键看分离条件,在金属螯合层析其实可选择:镍,铁,钴,铜,锌钙等离子,每种选择性都不同,洗脱的条件也是很有讲究的,包括重组蛋白HIS标签的位置都有很大的影响,因此其实没有哪种纯化是可以象试剂盒上写的操作规程那么简单。
ero11 (2013-5-13 16:57:21)
试试提高一下你的lysis buffer中的imidazole的浓度,从10mmol/L试起,包括20mmol/L、甚至可以到30mmol/L。这样柱子的特异性会提高些,但是,你的目的蛋白可能要损失大一些。对了,目的蛋白与柱子结合的时候最好不要用过柱的形式,把含有目的蛋白的细胞裂解液与柱子颗粒一起放在小锥形瓶中,用摇床孵育1h左右,然后再装柱洗脱,这样可能会好一些。仅供参考!
yueban-1147 (2013-5-13 16:57:51)
===========================================================================================================
关于NI与目的蛋白结合的时间,我有些疑问:Protocol上讲Ni与HIS TAG的结合能力强与抗原抗体反应,我因为作流式较多,知道一般的抗原抗体反应30min就可以得到很好的效果。而Protocol也说反应15-60min。是不是反应的时间过长会造成非特异性结合?一般的反应有必要反应到60min吗?是不是20min就可以了,这样反而可以减少非特异性结合。
如影随形 (2013-5-13 16:58:32)
===========================================================================================================
谢谢大侠的指教。我阅读您给我的信件。不过有个 问题。我发现您给的说明书上的SDS-PAGE结果也不是很纯。不知道诸位觉得是不是这样的结果就是很好的结果了。
76182260.jpg
summerxx (2013-5-13 16:59:02)
这个看你的需要,这样的纯度做抗体和做活性都没有问题了,而且我们做这个实验的时候是帮忙做的,只用了三天,纯度大于90%应该没有问题,而且收率在65%左右,这个是别人要的新基因表达的蛋白,所以看什么需求,当然如果你需要纯度特别高,那就还需要更精细的条件,当初我们只用三天完成了这个别人花了几个月没有做好的纯化,而他们是用进口的钴螯合介质,我们用的是自己的产品。
如影随形 (2013-5-13 16:59:21)
NI-NTA的重复利用:
文献上将,NI-NTA可以反复应用5次,直到resin的颜色由蓝色变为brownish-gray。然后就需要再生了。
不知道各位在应用时是不是如文献上所述?重复利用时有什么注意的事项吗?是不是重复利用柱结合蛋白的能力会随重复利用的次数增加而下降?
junhun (2013-5-13 16:59:43)
可以重复使用,其实就和别的柱子再生一样,然后再用EDTA洗去金属离子,然后洗掉EDTA,再螯合金属离子,这样就可以,我觉得其实有时候用完一次就最好再生一次,这样好保持最佳的分离效果和最好的重现性。需要注意的是样品最好要处理干净,特别是脂蛋白和糖蛋白包括核酸等这样的物质过多会使介质结块,从而影响介质的分离效果。
vivian4123 (2013-5-13 17:00:10)
文献上将,NI-NTA可以反复应用5次,直到resin的颜色由蓝色变为brownish-gray。然后就需要再生了。
不知道各位在应用时是不是如文献上所述?重复利用时有什么注意的事项吗?是不是重复利用柱结合蛋白的能力会随重复利用的次数增加而下降?
========================================================================================
1 重复利用可以,但是只能做同一种蛋白,不可以混用
2 重复利用结合力肯定降低,而且经常做不出来,包括回收的.纯化后蛋白含量可以忽略不计!而且回收较麻烦,尽可能不用算了.
orangecake (2013-5-13 17:00:31)
有一次我的纯化结果也是这样,后来发现是ni过量所致。加大了菌液量后就好了,可以再用sephdexG25柱脱盐一次,蛋白的损失量是很大,但是值得!我用的ni都没有再生,主要是怕掌握不好再生的技术,看说明书要用各种浓度的乙醇和niso4,EDTA洗来洗去,很惭愧,还好老板也认为再生了可能吸附量就不行了。NI纯化的起始应该是QIAGEN公司的包装好一些,NOVAGEN等其它公司也多来源以此。
junjie05 (2013-5-13 17:00:51)
其实纯化关键是介质,只要螯合好了镍离子的柱子,差别都不是很大,最有意思的是不少人做纯化一旦做不好就怀疑介质不好,我们一直用自己的产品,而且也重复使用,没有任何问题,我们最近准备制备1-2g带HIS标签的蛋白,25ml要近4000元,我觉得太贵了。
idea2011 (2013-5-13 17:01:12)
我在尝试用Ni-柱纯化并复性包含体蛋白,洗脱下来的目的蛋白条带很淡。(咪唑浓度为100mM)
另外我们实验室用的是invitrogen的ProBand Ni-树脂,参照说明书进行柱的再生,总是洗得不是太干净。(用EDTA,NaOH和NiCl2再生)
请大家多提意见!:)
S6044 (2013-5-13 17:01:32)
我想问:裂解前加lysis buffer和TE有什么区别,lysis buffer加的量对纯化有有关系吗,还有蛋白酶抑制剂的量
xueyouzhang (2013-5-13 17:04:19)
junjie05 (2013-5-13 17:04:46)
【讨论帖】Ni柱纯化蛋白结果,敬请批评。