军事医学科学院Hepatology解析干细胞与癌症
近日来自军事医学科学院的研究人员在新研究中,揭示了间充质干细胞(MSCs)在肝癌进程中发挥重要作用及其机制。相关论文发表在在国际著名肝脏疾病杂志Hepatology上(最新影响因子11.665)上。
军事医学科学院输血研究所的裴雪涛(Xue-Tao Pei)教授和岳文(Wen Yue)研究员为这篇文章的共同通讯作者。裴雪涛主要从事干细胞生物学与再生医学的基础及应用研究。在国内外学术杂志发表论著100余篇。2005年曾于第2届世界再生医学大会获得唯一最高荣誉奖——Paul H Fraisse (保罗•弗雷泽)“最佳科学贡献奖”,这一殊荣是中国科学家在该领域获得的最高奖项。岳文研究员主要从事干细胞发育分化调控机制,尤其是表观遗传学调控机制的研究。
间充质干细胞(MSCs)是干细胞家族的重要成员。这种纺锤形细胞能分化为成骨细胞、脂肪细胞、神经细胞及多种结缔组织细胞。其高度自我更新能力,较弱的免疫源性,易于体外分离培养、扩增,容易导入外源基因等特性,使之在细胞治疗和基因治疗方面显示出广阔的应用前景,MSCs基础和临床应用研究已经成为生物医学研究的热点和前沿。
近年来,MSCs和肿瘤细胞的相互关系也引起了学者的关注。然而大量实验结果表明MSCs和肿瘤的关系存在两面性:一方面研究表明MSCs抑制肿瘤细胞生长,另有研究却表明MSCs能够促进肿瘤的生长和转移,甚至有研究报道MSCs能发生恶性转化,获得肿瘤细胞的相关生物学特性。目前,尚未有肝癌相关的MSCs (LC-MSCs)与肝癌之间相互作用的相关报道。
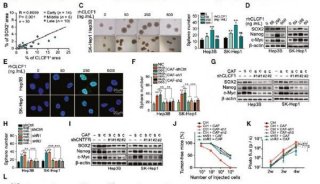
在这篇文章中,研究人员首次确定了肝癌组织中MSCs的存在。他们还分别在体内外实验中证实,LC-MSCs显著促进了肿瘤生长以及瘤细胞球形成。在原位肝移植模型中,研究人员证实LC-MSCs促进了肝癌转移。cDNA微阵列分析表明,相比来自邻近无癌组织的肝脏正常MSCs (LN-MSCs),LC-MSCs中的S100A4表达显著增高。重要的是,抑制S100A4可导致肝癌细胞增殖和侵袭受到抑制。而在肝癌细胞中外源性表达S100A4则可导致肿瘤增大,转移灶增多。研究结果表明LC-MSCs分泌的S100A4促进了肝癌细胞增殖和侵袭。
随后,研究人员证实,S100A4异位表达及LC-MSCs共培养可显著上调肝癌细胞中致癌miR-155表达。采用miR-155抑制剂即可显著减弱S100A4的促侵袭效应。这些结果表明S100A4是通过调控肝癌细胞中的miR-155表达来发挥作用。研究人员证实LC-MSCs分泌的 S100A4促进了miR-155表达,转而介导了细胞因子信号转导抑制因子1(suppressor of cytokine signaling-1,SOCS1)下调,导致随后的STAT3信号激活。由此促进了MMP9表达,导致肿瘤侵袭性增高。
新研究表明LC-MSCs通过分泌S100A4参与调控了肝癌进程,从而为肝癌治疗提供了一个潜在的靶点。
-
项目成果
-
焦点事件