MALDI-TOF在诊断传染性疾病中的应用
Christopher Doern博士是西南德克萨斯州立大学儿科病理学助理教授,达拉斯儿童医学中心临床微生物学主任,该儿童医学中心是美国第一家应用MALDI-TOF串联质谱法鉴定微生物的儿科实验室。2013年7月29日Christopher Doern博士于2013年AACC年会上发表题为《Applications of MALDI-TOF for the Diagnosis of Infectious Diseases》的报告,介绍了使用这项新技术的经验及其如何改变我们诊断传染病的方式,现将Doern博士的演讲整理如下,以期指导该技术在临床实验室中的应用。
质谱分析法在微生物学中是一种创新,该基础入门课程介绍了这项技术的不同组成部分,工作原理,确认程序,未来可能应用的方向,以及使用这项技术对病人护理的影响。
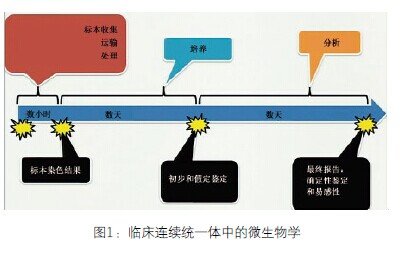
为了了解MALDI-TOF的影响,必须了解诊断传染病的程序以及我们面对的连续统一体(continuum)。从传统上来讲,微生物学实验室是最慢的实验科室,可能需要数天来完成检测。我们从标本收集、运输和处理开始,在医院中需要数小时。然后是培养阶段,也是使我们落后的阶段,在没有获得微生物之前我们什么也做不了。标准的细菌微生物培养需要24-48个小时,真菌或分支杆菌培养时间更长。最后是分析阶段,时间为一天或更长,分析方法通常依据培养而定。因此,在发布确定性鉴定和易感性结果之前需要数天(图1)。那我们在哪里做治疗决定呢?因为改变病人管理的方式是我们的目标,所以答案是在整个过程中。医生在决定病人患病的期间调整治疗方法,因此我们尽可能发布更多信息。问题在于让微生物学家受挫折的是,在他们获得最可靠最确定的信息之前医生已经做了3或4个治疗决定。最后,在大多数情况下我们对病人治疗方法的作用很小。
图1 临床连续统一体中的微生物学
微生物学为什么这么慢?一个很好的例子是在分析之前需要培养。我们经常面对混合培养,不只有一个分析物,有些标本包含很多不同的微生物。如果我们对其中一种微生物感兴趣我们必须再次培养(subculture),经过纯粹培养后才能进行鉴定。我们使用基于培养的系统,这也需要时间。5-10年后,我们可能直接根据标本类型检测鉴定,但是现在我们还没有到那个程度,所以我们仍需收集标本,培养标本然后分析。
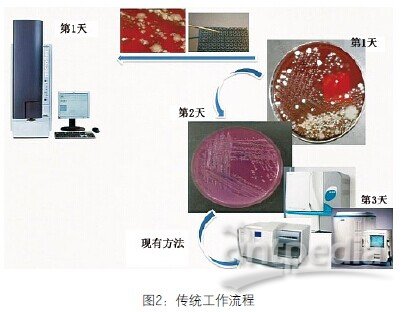
传统做法是先培养,观察到微生物后再次培养。微生物生长时间需要16-18个小时,然后进行鉴定和敏感试验,鉴定最少需要6-8个小时,直到获得鉴定结果需要3天。MALDI-TOF可从单菌落或单分离菌落鉴定。我们之前做次代培养,现在直接把微生物放到钢板上,放入仪器分析。这是蛋白分析,不是基于培养的分析。生物化学反应通常需要6-24个小时,现在我们只需30秒。周转时间得到显著提高。
图2 传统工作流程
细菌鉴定MALDI-TOF技术有2个选择:一个是Bruker Microflex(布鲁克),另一个是bioMerieux Vitek MS(生物梅里埃),都仅供研究使用(RUO),都在申请FDA批准。我们实验室使用的是BrukerMicroflex,但是两个仪器或两项技术的工作流程是相似的。因此,使用Bruker Microflex的很多经验也适用于bioMerieux Vitek MS。
图3 两个厂商的仪器图,左:Bruker Microflex(布鲁克),右:bioMerieux Vitek MS(生物梅里埃)
MALDI-TOF程序
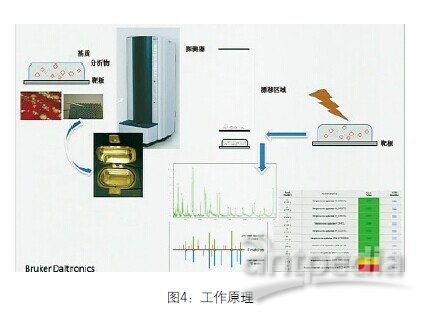
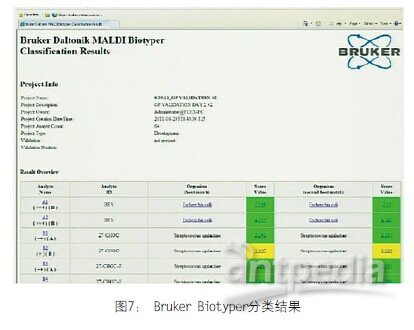
标准工作流程是把标本和基质放到靶板上,待其干燥,放入容器。在分析阶段,激光电离使蛋白质产生光谱。光谱图分析本质上就是微生物的指纹谱。把蛋白质分析与数据库比较,数据库包括代表各种微生物的4,000或5,000个不同光谱。模式匹配得出分数,分值大于2.0鉴定到种,所以绿脓杆菌是确信的物种。分值在1.7-2.0之间鉴定到属,即可以鉴定到假单胞菌属而不能鉴定出是绿脓杆菌。为了微生物学家简便起见,还做了颜色编码。绿色代表可以继续(确信物种),黄色代表警告(确信属),红色代表停止(鉴定不可信),见图4。
图4 工作原理
有很多种基质作为研究工具用于微生物学实验室,常用的MALDI基质物质如下所示:
肽 类:4-羟基-α-氰基肉桂酸(HCCA)
蛋白质:2,5-二羟基丙酮(DHAP)
芥子酸(SA)
2,5-二羟基苯甲酸(DHB)
多 糖:2,5-2,5-二羟基苯甲酸(DHB)
核 酸:3-羟基吡啶酸(HPA)
2,4,6-三羟基苯乙酮(THAP)
不同类型样品使用不同的基质与电离特殊样品混合物所需的能量(每种基质显示特定能量阈值)和特殊样品混合物的稳定性(热基质可导致样品化合物的非预期断裂)有关。
与我们所做的相比,MALDI-TOF程序既美观又简单(图5)。微孔板大小与信用卡差不多。“信用卡”内有96个孔,非常小,需要在文件上记录微生物的位置,用牙签进行定位,用移液管把基质移取到微板上。分子生物学家能够非常熟练使用移液管,而细菌生物学家则不行。他们在实验室做到良好配合,细菌生物学家负责前期工作,分子实验室负责移液工作,待靶板干燥,放入仪器。对于微生物学家来说这完全是外来技术,仍需要学习使用这项技术。
图5 MALDI-TOF程序
该质谱仪仍是RUO仪器,我们可以看到和改变其中的任何设置(图6)。比我们在任何FDA批准仪器中看到的都多。从质谱仪内的一个小摄像机,你可以看到激光发射,从而评估标本质量。最重要的一个特点是可以获得均匀分布的标本。不幸的是,一旦经FDA批准,这些就看不到了。我们必须实时观察数据采集。你越熟悉这项技术,就能越早进行评估。
图6 改变质谱仪的设置
最后一步是分析,技师如何看待读数? 我们有评分系统,给予一级和二级鉴定。一方面这样是好的,但也给我们带来了问题。我们得到一个分值描述或鉴定描述,必须知道如何处理。
图7 Bruker Biotyper分类结果
现在MALDI-TOF可以专业鉴定所有细菌,厌氧菌、所有革兰氏阳性菌和革兰氏阴性菌,可以很好地鉴定酵母菌和分枝杆菌,还可以直接根据血培养阳性进行鉴定。这不是直接从病人鉴定,但是如果你熟悉血培养协议,可把血液注射到瓶子中培养一段时间,获得标记结果为阳性,我们可以使用MALDI-TOF对该材料进行直接鉴定,所以它是非常强大的应用。
MALDI-TOF的其它好处。欧洲使用MALDI-TOF已有5年,比美国早很久,所以他们有我们没有的经验。他们发现MALDI-TOF是非常可靠的革兰氏染色形态学测定。即使没有得到很好的鉴定结果,革兰氏染色结果也总是正确的。我提到欧洲的原因是他们现在所做的正是消除革兰氏染色,这对于我们微生物学家来说是残忍的,因为我们对任何微生物都做革兰氏染色。但是他们发现革兰氏染色是不必要的,因为MALDI-TOF结果非常可靠。另外,MALDI-TOF不会得出“错误”答案。虽然有些夸大,但是该技术使人耳目一新的是当它给出一个答案,可以确信答案是正确的。
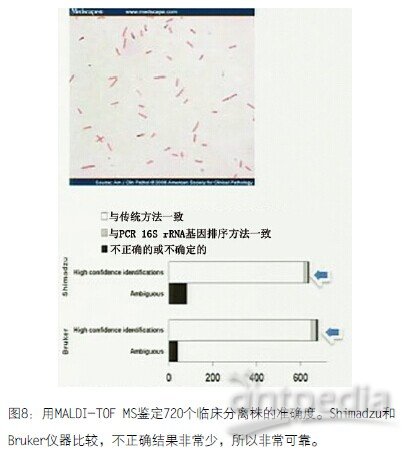
图8 用MALDI-TOF MS鉴定720个临床分离株的准确度。Shimadzu和Bruker仪器比较,不正确结果非常少,所以非常可靠。
另外,数据库可以随着时间完善,这对于观察到不同类型菌株的实验室来说是很重要的。如果我获得了原来未鉴定的微生物,比如未鉴定的酵母菌,然后加入到数据库,数据库变得更大更好。
MALDI-TOF的局限性。虽然MALDI-TOF很可靠,但是它无法区分肺炎链球菌和轻型链球菌/口腔链球菌,我们仍需使用较慢的标准生化试验。志贺菌属是重要的胃肠道病原体,基本上等同于大肠杆菌。志贺菌属不在数据库内,所以MALDI-TOF无法鉴定志贺菌属。MALDI-TOF还无法进行敏感试验和鉴定混合标本。MALDI-TOF不会告诉你标本存在两种不同的微生物,而只是告诉你存在微生物及其丰度。
确认程序
确认MALDI-TOF对临床分离株的鉴定能力,就要确认它的重要组成部分。首先是点样技术(spotting technique),如何使微生物定位到靶板上。其次,从什么培养基上进行点样?走进微生物学实验室,你会发现10-15种不同的培养基。你可以想象对于以蛋白质为基础的分析,不同类型的培养基鉴定结果不同。第三是点样滞后时间,在靶板上点样一段时间后再鉴定。最后根据微生物种类进行确认。在最后确认时与常规实验室方法比较,解决与16S测序方法的差异结果。
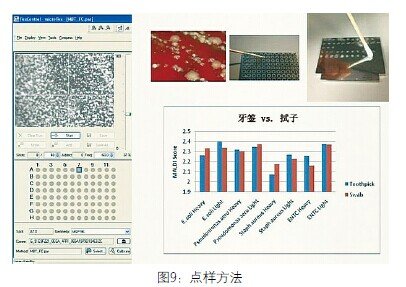
点样方法。进行良好鉴定最重要的就是获得均匀分布的样品。我们想象牙签的尖端不能做好点样工作,所以在实验室中我们开始使用的是拭子,但是后来发现有微粒从拭子上掉下来,就换成了牙签。幸运的是,我们预先对牙签和拭子都做了确认研究。之前提到分值范围是1-3,图9中Y轴缩短为1.9-2.5。在质谱鉴定中我们还要做浓缩。对同一种微生物进行重应用(heavy application)和轻应用(light application),包括大肠杆菌、绿脓杆菌、金黄色葡萄球菌、ENTC(肠球菌)。在所有这些鉴定中没有显著统计学差异,分值都超过了2.0。所以牙签或拭子都可用于我们的研究,只是我们一开始使用的是拭子。
图9 点样方法
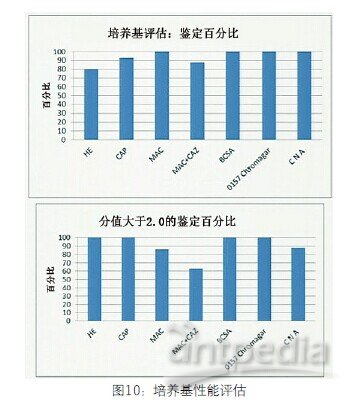
培养基性能评估。微生物学工作流程的一个重要部分是次代培养获得纯粹生长(图1)。检测从选择性培养基获得的之前经过特性化描述的相关微生物的次培养物。(图10)上图反映随机阈值是70%鉴定率。如果你想从图中任何一个培养基进行鉴定,有些是非常合适的筛选培养基。从图中可以看出所有培养基的鉴定率都远大于70%。 在获得鉴定结果时,我们希望鉴定分值大于2.0或者是可靠的鉴定。从下图来看,在大多数情况下鉴定率都很好,只有MAC+CAZ效果不太好。
图10 培养基性能评估
数据库评估/确认。如果你想确认实验室的所有代表微生物,你就不能按照实验室接收的检验申请来确认。因为我们在实验室看到的95%微生物都是大肠杆菌和葡萄球菌。革兰氏阴性菌的范围广泛,代表菌类有肠杆菌科、葡萄糖非发酵菌、需要复杂营养的革兰氏阴性杆菌和双球菌。确认标准是最少300个分离株。每个种不超过20个分离株,每个属不超过30个分离株。可用相关微生物例如GC(淋球菌)、B. cepacia(洋葱伯克霍尔德菌)、HACEK等等增补。
革兰氏阳性菌没那么多样化,纳入标准较为宽松。确认标准是最少200个分离株。每个种不超过30个分离株,每个属不超过50个分离株。代表菌类球菌和杆菌。革兰氏阳性菌的代表较少,可用棒状杆菌属、诺卡氏菌属等相关微生物增补。
革兰氏阳性和阴性厌氧菌的最低纳入标准是最少100个分离株。每个种不超过20个分离株,确认必须包括至少5个物种。酵母菌的最低纳入标准是最少100个分离株,每个种不超过30个分离株。这些只是最低目标,我们在做实验时通常超过这个数量。
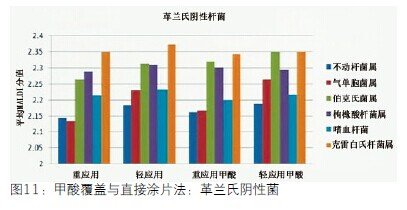
原始的简单工作流程一般是先点样微生物和覆盖基质,然后进行鉴定。结果表明这种方法对于有些微生物效果不太好。所以我们把微生物点在靶板上然后用甲酸覆盖,从而使蛋白质显现出来。最后用基质覆盖。这样需要更长时间。从图11来看,事实上甲酸覆盖对于革兰氏阴性菌没有多大变化。与我们预想的一致,它们的蛋白质本来就可以检测到,所以,甲酸覆盖没有优势。大多数物种都被可靠鉴定出来,能非常可靠地鉴定伯克氏菌属。但是,5个成团泛菌中没有一个被鉴定出来。
图11 甲酸覆盖与直接图片法:革兰氏阴性菌
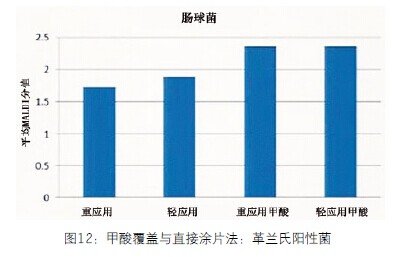
使用或不使用甲酸对革兰氏阳性菌的影响完全不同(图12)。未使用甲酸的失败率高(80%)。使用甲酸的失败率只有5%,鉴定正确率为100%。使用甲酸可100%鉴定到种,平均分值是2.36。失败=无峰值或无可靠的鉴定。
图12 甲酸覆盖与直接图片法:革兰氏阳性菌
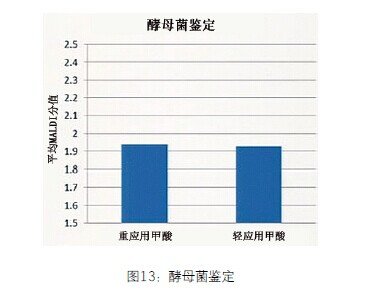
甲酸覆盖对酵母菌鉴定更好。对于酵母菌鉴定,不使用甲酸的鉴定率只有8%。因此,重复检测的可能性是92%。如果使用甲酸,鉴定率是100%且分值在1.7以上的鉴定都是正确的。这样以来使厂商的推荐阈值从分值在2.0以上降低到1.7以上。
图13 酵母菌鉴定
解释数据和解决问题
复合菌问题
像这样改变工作流程时,会出现很多问题。其中一个问题是“复合菌”问题。微生物分类广泛,有很多亚群。MALDI-TOF能把复合菌内的很多微生物鉴定到物种水平。例如,实验室最常见的两种非常重要的病原体,阴沟肠杆菌和洋葱伯克霍尔德菌。但是它们是非常复杂的种群,包括大量其它微生物(表1)。
表1 MALDI-TOF鉴定复合菌
未来应用
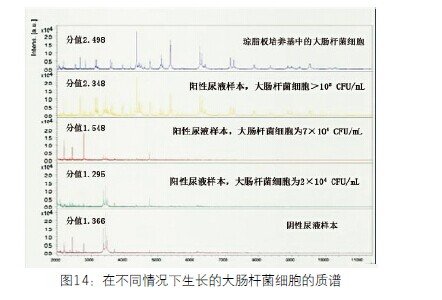
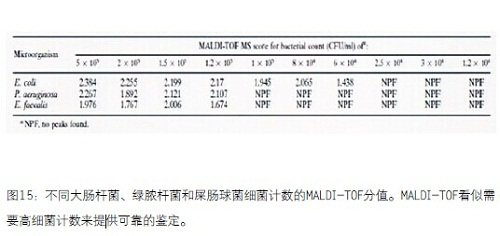
直接标本检测。根据使用标本类型不同,进行鉴定需要的微生物单位要求不同,例如尿液-100,000CFU/mL,血液10-1,000CFU/mL,而CSF要求的微生物范围广泛。另外,可以直接鉴定多微生物标本吗?答案是不能得出是哪种微生物,只可以告知存在微生物及其丰度。从各种情况来看,对尿液标本进行直接检测是最好的,尿液的有意义临床阈值是100,000CFU/mL。因为对于绝大多数尿路感染(UTI)来说,唯一关心的就是物种丰度。在临床化学杂志第49卷第4期Ferreira等人(文章标题:利用基体辅助激光解吸电离飞行时间质谱直接鉴定尿样中的尿路感染病原体)比较了琼脂培养板上菌落与尿液样品中菌落的MALDI光谱(图14)。黄色质谱的大肠杆菌大于105CFU/mL,分值为2.348,是很好的鉴定。红色质谱的大肠杆菌7x104CFU/mL,分值为1.548,不是很可靠的鉴定。所以,直接标本检测几乎是尿路感染的配套诊断检测。
图14 在不同情况下生长的大肠杆菌细胞的质谱
图15 不同大肠杆菌、绿脓杆菌和屎肠球菌计数的MALDI-TOF分值。MALDI-TOF看似需要高细菌计数来提供可靠的鉴定
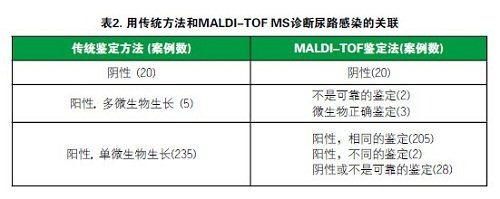
用传统鉴定法和MALDI-TOF法处理经筛查设备报告为阳性的260例尿液样品。结果如表2所示。筛查设备报告为阳性的20例样品在培养结果中显示为阴性。在这20例样品中MALDITOF没有发现任何显著的蛋白质分析。筛查结果为阳性的5例样品导致培养中两种菌落大量生长。在这些样品中,MALDI-TOF报告了2例不可靠鉴定,另外3例微生物正确鉴定。在传统方法鉴定的235例单微生物标本中,MALDI-TOF检测到205例相同的微生物,和28例阴性或不可靠鉴定。证明MALDI-TOF不能保证100%可靠的鉴定。
表2 用传统方法和MALDI-TOF MS诊断尿路感染的关联
敏感试验。微生物有不同的抗药方式。迄今为止最常见的是酶促改变/酶促降解。微生物事实上改变了药物本身,例如β-内酰胺。微生物进行有效活动使抗生素氢化或分解抗生素。所以我们应用MALDI-TOF进行敏感试验。其他机制包括微生物改变抗生素的靶标或某些靶标生产过剩等。
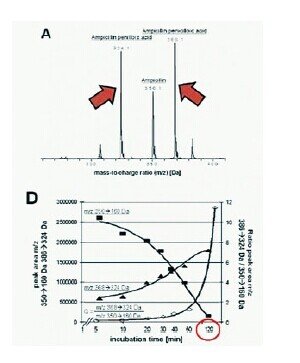
使用MALDI-TOF快速检测氨苄青霉素抗药性。用测试微生物孵育纯化氨苄青霉素2小时后测量分解产物(Grundt et al. 2012. JCM)。这个实验不是检测机制本身,而是检测机制的产物。标准敏感试验需要24个小时或更长,是个很慢的过程。MALDI-TOF使抗生素完全氢化到可以测量的点需要2个小时,因此敏感试验需要2个小时。局限性是我们只能告诉医生不能使用氨苄青霉素,不能告诉其他类型抗生素的信息。
图16:(A)MS全扫描分析表明氨苄青霉素及其水解产物氨苄青霉素-青霉酸和青霉噻唑酸的检测。(D)动力学细菌氨苄青霉素水解分析表明氨苄青霉素的量不断降低而相反氨苄青霉素-青霉酸增加。氨苄青霉素在120分钟后完全降解。孵育30分钟后,药物/代谢物之比能可靠地区别氨苄青霉素易感性和抗药性。
使用MALDI-TOF检测碳青霉烯抗药性是另一个热点。近年来,抗碳青霉烯类细菌的百分比以令人担忧的速度在上升并成为病人存活率的重大威胁。可使用MALDI-TOF质谱法通过检测碳青霉烯降解来证实碳青霉烯酶诱导的碳青霉烯抗药性。这种方法对携带NDM-1、VIM-1、VIM-2、KPC-2和不同 IMP酶的菌株有效(Burckhardt andZimmermann. JCM. 2011. 49(9):3321-4)。
菌株分型。坦白来说,使用MALDI-TOF进行菌株分型较慢(可能在一天或两天内完成),通常不能在有用的时间段里得出结果。但是有可能比PFGE(脉冲电场凝胶电泳)、多种测序分型、快速PCR快而便宜。MALDI-TOF可区别的微生物包括弧菌,军团菌属,大肠杆菌,拟杆菌属,克雷白氏杆菌属,金黄色酿脓葡萄球菌。
MALDI-TOF对病人护理的临床影响
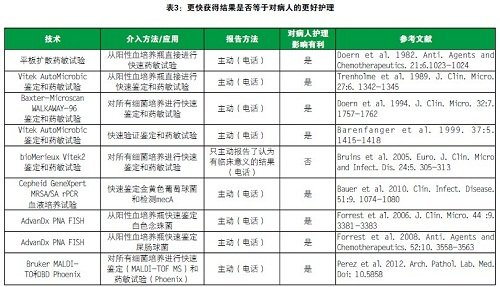
我们在实验室使用MALDI-TOF大约1年。下表总结了很多微生物学评估。它们使用这些技术评估对病人护理的影响是否有利。除了一个案例(红色标注),其他所有案例采用的技术都对病人护理的影响有利。
表3 更快获得结果是否等于对病人的更好护理
MALDI使用前发布鉴定结果的时间是从6:00 AM或8:00AM到3:00PM或4:00PM,这是一个非常宽泛的时间窗口。基本上意味着医生不知道到底什么时候得到信息。使用MALDI的目标是80%的鉴定结果要在12:00PM之前报告出来。在预计时间发布信息可提高医生的理解力。在临床传染病杂志第49卷第4期上Seng等人表示在下午1点申请检测,第二天上午9:30可获得结果。
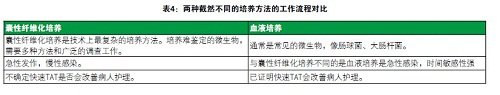
表4 两种截然不同的培养方法的工作流程对比
囊性纤维化培养
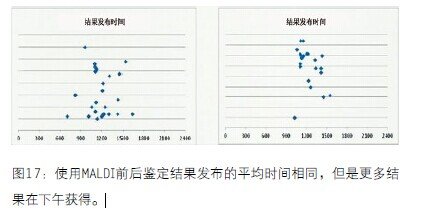
在MALDI使用前明确性鉴定的平均时间是141个小时(5.9天),在MALDI使用后明确性鉴定的平均时间是77个小时(3.2天),所以鉴定时间有了显著提高。MALDI-TOF不做敏感试验,预计周转时间不会变化。但是,事实上在MALDI使用前易感性测试的平均时间是134个小时(5.6天),而在MALDI使用后平均时间为105个小时(4.4天)。因此即使我们不做敏感试验,周转时间也提高了。为什么会这样呢?原因是在你知道微生物是什么值钱,不能发布敏感试验结果。在MALDI使用前,鉴定所需的检测方法的平均数量是1.5个方法。这个数字听起来不多,但是也就是说三分之一的培养需要一个以上方法,意味着我们第一次没能鉴定微生物,还要用另外的方法来鉴定。在MALDI使用后鉴定所需的检测方法的平均数量是1个方法,除了MALDI-TOF,我们不用其他方法。总的来说,使用MALDI-TOF使鉴定结果提前2.7天发布,敏感试验结果提前1.2天发布。使用MALDI前后,培养开始的平均时间是下午3点和2点。鉴定结果发布的平均时间都是下午12点。使用MALDI之前,48%的结果在下午12点之后发布;使用MALDI之后,52%结果在下午12点之后发布。所以我们几乎在同一时间获得培养和鉴定结果发布。这有些令人失望,因为我们每天9:30开始MALDITOF,希望更早获得结果。但是使用MALDI前的标准差是215分钟,使用MALDI后的标准差是139分钟。使用MALDI后的时间窗口更小。
图17 使用MALDI前后鉴定结果发布的平均时间相同,但是更多结果在下午获得
血液培养
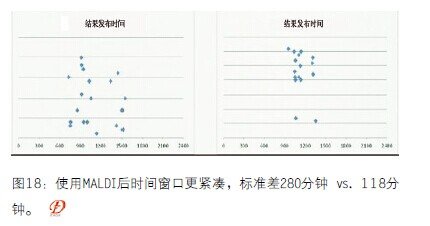
血液培养是迄今为止较为紧急的临床培养。在MALDI使用前明确性鉴定的平均时间是81个小时(3.4天),在MALDI使用后明确性鉴定的平均时间是54个小时(2.3天)。我们多了另外20多个小时进行次代培养。MALDI使用前易感性测试的平均时间是95个小时(4.0天),而在MALDI使用后平均时间为73个小时(3天)。我不知道为什么敏感试验的时间会提高,但是唯一合理的解释应该与囊性纤维化培养相似。鉴定结果提前1.1天发布。敏感试验的周转时间提前了1天。使用MALDI前后,培养开始的平均时间都是下午2点。鉴定结果发布的平均时间分别是上午11点,和上午11:30(但是提前一天的11:30)。使用MALDI后,只有15%结果在下午12点之后发布。所以,我们不仅提前了1天获得鉴定结果,还是在提前1天的早些时候获得的。
图18 使用MALDI后时间窗口更紧凑,标准差280分钟 vs. 118分钟