哈尔滨工业大学Nature发表艾滋病研究重要成果
人类免疫系统利用各种适应机制和天然机制来对抗HIV病毒感染及艾滋病。其中最为重要的就是,通过一些称之为限制因子的广泛表达蛋白来有效地抑制病毒复制。然而,包括HIV-1在内人类和猿猴的免疫缺陷病毒会编码一些专门的调控蛋白,使得它们能够逃避限制因子,由此确保病毒能够在宿主细胞中生存和增殖传播。
现在来自来自哈尔滨工业大学和清华大学的研究人员,揭示了HIV-1病毒的Vif调控蛋白如何结合到重要的宿主细胞配体和靶标上,最终除去感染细胞的限制因子的机制。这一重要的研究发现在线发表在1月8日的《自然》(Nature)杂志上。
领导这一研究的是哈尔滨工业大学生命科学与技术学院的黄志伟(Zhiwei Huang)教授。其主要研究方向为结构分子生物学与天然免疫信号转导。2011年当选教育部“新世纪优秀人才”。
Vif蛋白是由除马传染性贫血病毒之外所有的逆转录慢病毒所编码的一种病毒辅助蛋白。HIV-1病毒编码的Vif蛋白将限制因子胞嘧啶脱氨酶 APOBEC3G招募到到包括支架蛋白Cullin5(CUL5)、底物接头蛋白ElonginB(ELOB)和ElonginC(ELOC)形成的泛素连接酶E3复合物处,促进APOBEC3G聚泛素化和降解,由此抑制APOBEC3G介导的细胞防御。
此外,近期有研究发现HIV-1 Vif还同时劫持另一个宿主蛋白CBF-β形成了Vif–CBF-β–CUL5–ELOB–ELOC复合物。由于其在HIV感染中发挥极其重要的作用,Vif被视作为是抗HIV-1药物的一个极好的靶点。
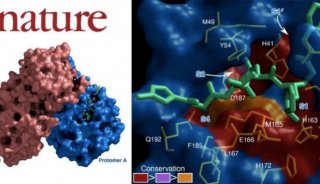
在这篇文章中,研究人员报告了由Vif–CBF-β–CUL5–ELOB–ELOC复合物的首个晶体结构。这一晶体结构显示,Vif通过两个结构域与CBF-β、CUL5和ELOC相互作用,组织形成了这一五聚物复合物,因此在这一复合物中占据了重要的核心位置。Vif通过一个较大结构域(α/β- domain)与CBF-β结合。相比之下CBF-β只与Vif接触,似乎发挥了伴侣蛋白样的作用,帮助了Vif折叠成活化构象。有趣的是,研究人员发现 Vif是模拟了SOCS2,通过另一个较小的结构域(α-domain)与ELOC和CUL5相互作用。SOCS2是参与生长激素下游信号的一种CRL泛素连接酶底物受体。这表明两种蛋白均采用了一种类似的机制来招募CRL5。此外,Vif有一个独特的锌指模体定位在两个Vif结构域之间,没有与其他蛋白质接触,但却对α-domain构象起稳定作用,其有可能在Vif–CUL5互作中发挥了重要的作用。
这些研究数据揭示了Vif劫持CBF-β和CUL5 E3连接酶复合物的结构基础,从而为设计出新型的抗HIV药物奠定了理论基础。
-
科技前沿
-
项目成果
-
焦点事件

-
焦点事件
-
焦点事件