973首席科学家Nature子刊发表CRISPR新文章
来自深圳大学第一附属医院的研究人员基于CRISPR-Cas9系统,构建出了可以鉴别、靶向和控制膀胱癌细胞的与门(AND gate)遗传回路。这一重要的研究成果发表在11月6日的《自然通讯》(Nature Communications)杂志上。
国家973计划首席科学家蔡志明(Zhiming Cai)教授以及深圳大学第一附属医院的黄卫人(Weiren Huang)博士是这篇论文的共同通讯作者。蔡志明教授主要研究方向为泌尿生殖系统肿瘤、男性不育的发病机制和转化医学研究。并担任中组部“千人计划”等高层次人才评审专家,国内外多个学术刊物主编、副主编、编委,Nature Genetics 等国际著名刊物审稿专家。黄卫人博士主要开展肿瘤合成生物学治疗、泌尿生殖系统肿瘤发生机制、生殖医学研究。
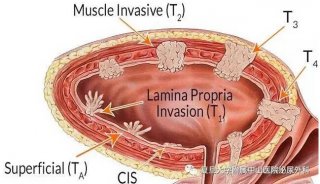
膀胱癌是泌尿系中最常见的恶性肿瘤,构成膀胱的各种组织均可发生癌变。膀胱癌可分为2大类,即从上皮组织发生的肿瘤如移性上皮癌、腺癌及鳞状上皮癌和其他非上皮细胞性肿瘤。膀胱癌在中国的发病率和死亡率均占泌尿系肿瘤的首位。目前,中国男性膀胱癌的年发病率已达十万分之八,并呈逐年上升的趋势。
由于膀胱癌早发现早治疗比较困难,晚期癌症患者又往往会失去手术的机会。癌症治疗一直存在癌细胞和正常细胞“通杀”,病人对放疗和化疗容易耐药等一系列的技术瓶颈,严重影响病人的治疗效果。
近年来,蔡志明教授提出了“用合成生物器件来干预膀胱癌”的新思路:通过筛选膀胱癌有效治疗靶点,注入细菌和T淋巴细胞,合成具有个性化攻击力的“武器”,直捣癌变老巢。致力推动癌症治疗实现“私人定制”。
CRISPR (clustered regularly interspersed short palindromic repeats)/Cas是源于细菌及古细菌中的一种后天免疫系统,它可利用靶位点特异性的RNA指导Cas蛋白对靶位点序列进行修饰。直到近年,科学家们才开始利用这一系统在活体动物基因组中生成靶向突变,删除原有的基因或插入新基因。迄今为止,研究人员已将CRISPR/Cas系统成功应用于人类、小鼠、斑马鱼、家蚕、果蝇、酵母、拟南芥及水稻等多个物种中。亦被用于广泛探索癌症、艾滋病等一系列人类疾病的机理及靶向治疗研究。
在这篇文章中研究人员报告称,他们基于CRISPR-Cas9系统构建出了模块与门遗传回路。这一遗传回路整合了来自两个启动子的细胞信息作为输入端,只有当在测试细胞系中两个输入端均活化时才会激活输出信号。利用荧光素酶报告基因最为输出基因,他们证实相比于人类端粒酶逆转录酶(telomerase reverse transcriptase) -海肾萤光素酶(Renilla luciferase)构件,这一回路可以特异性地检测膀胱癌细胞,并显著提高荧光素酶的表达。
此外,通过采用其他的细胞功能基因包括hBAX、p21和E-cadherin来替代荧光素酶报告基因作为输出基因,研究人员还对设计的模块性进行了测试。结果表明,通过调控相应的基因这些回路能够有效地抑制膀胱癌细胞生长,诱导凋亡,减少细胞运动性。这种方法为体外靶向和控制膀胱癌细胞提供了一个合成生物学平台。