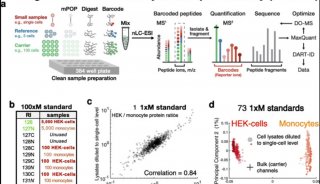
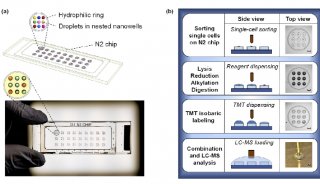
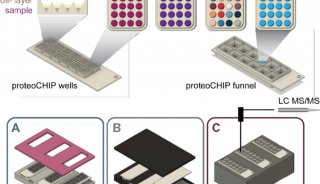
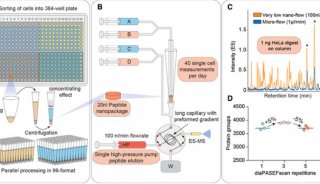
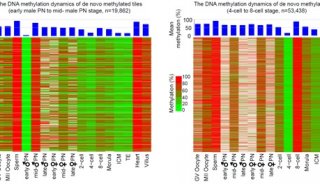
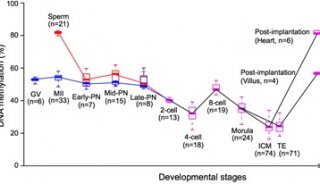
厦门大学PNAS表观遗传学新文章
来自厦门大学、加州大学圣地亚哥分校的研究人员证实,热休克蛋白HSP70精氨酸甲基化调控了维甲酸介导的RARβ2基因激活。这项研究发布在6月16日的《美国国家科学院院刊》(PNAS)上。
厦门大学药学院的刘文(Wen Liu)教授和加州大学圣地亚哥分校的Michael G. Rosenfeld教授是这篇论文的共同通讯作者。刘文教授主要从事表观遗传调控子(组蛋白修饰酶、去修饰酶、识别修饰的识别子、非编码RNA)在基因转录调控中的作用分子机制研究,及其在癌症等重大疾病发生发展中的应用研究;同时也致力于探寻靶向表观遗传调控子的活性小分子。论文发表在Nature,Cell, Cancer Cell,Molecular Cell, PNAS等科学期刊。
热休克蛋白(HSPs)又称应激蛋白(SP),是机体细胞在一些应激原如环境高温、缺氧、重金属中毒、氧化应激、感染、饥饿、创伤、代谢毒物等条件诱导下,激活HSP基因,高效表达的一组进化上高度保守的蛋白质,对机体免受应激因素的损害具有重要作用。近来的研究确立了一些“组蛋白”甲基转移酶和去甲基化酶调控了转录程序,并利用了非组蛋白来作为底物,但尚未深入调查它们对细胞核中HSPs的调控作用。
根据分子量的大小HSPs可分为以下几个家族,即HSP100、HSP90、HSP70、HSP60以及小HSP。HSP70是热休克蛋白家族中最为重要的一族,有20余个成员,进化上高度保守。HSP70作为一种非特异性的细胞保护蛋白,是目前发现的主要分子伴侣蛋白之一,可维持细胞蛋白自稳,提高细胞对应激原的耐受性,使细胞维持正常的生理功能。HSP70分布广泛,参与许多细胞的正常生理过程,直接参与了蛋白质从初生链合成到多亚基复合体折叠、装配的整个生物合成,并参与了蛋白质向内质网的易位、参与了分解错装的蛋白质等,并与新生肽和多肽链中错配的部分结合,对调节蛋白质内环境的稳定具有重要作用。
在这篇文章中研究人员报告称发现,在体外和培养细胞中CARM1/PRMT4和JMJD6可分别使得HSP70的高度保守精氨酸残基R469单甲基化和脱甲基化。功能研究揭示HSP70可通过结合染色质直接调控维甲酸(RA)诱导的RARβ2基因转录,R469甲基化是这一过程的必要条件。HSP70在基因转录调控中所起的作用似乎不同于它的分子伴侣蛋白活性。研究人员证实R469甲基化介导了HSP70与TFIIH直接的互作,后者与RNA聚合酶II磷酸化及转录起始有关联。
新研究扩展了PRMT4和JMJD6靶向非组蛋白底物的清单,并揭示了除在蛋白质折叠和质量控制中的经典作用之外,HSP70蛋白在染色质水平上调控基因转录的新功能。
-
项目成果

-
科技前沿

-
科技前沿
-
科技前沿
-
科技前沿
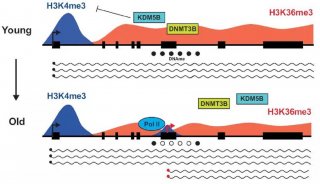
-
项目成果

-
项目成果
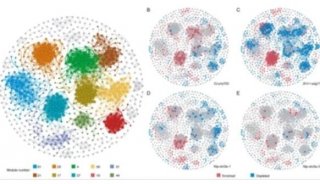
-
项目成果
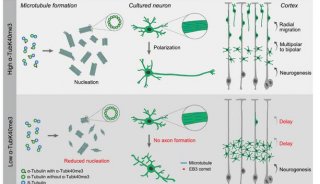
-
企业风采

-
科技前沿

-
科技前沿

-
科技前沿

-
技术原理

-
焦点事件

-
项目成果
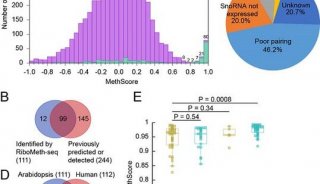
-
项目成果
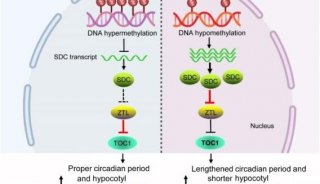
-
科技前沿
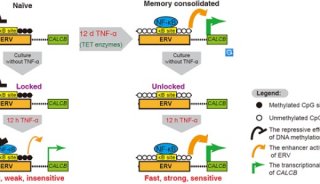
-
科技前沿
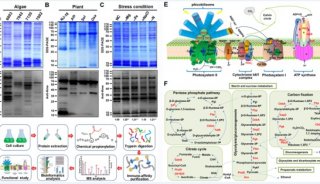
-
项目成果

-
焦点事件

-
焦点事件
-
项目成果
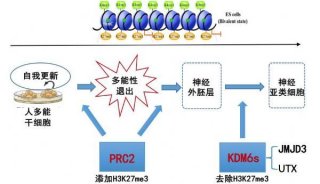
-
项目成果

-
项目成果
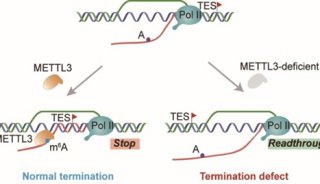
-
项目成果
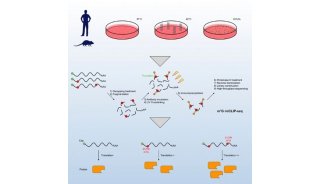
-
焦点事件
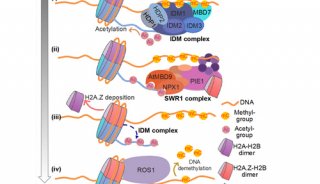
-
项目成果

-
项目成果
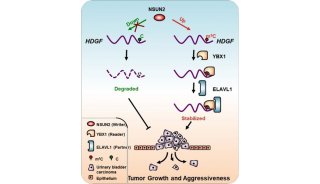
-
项目成果
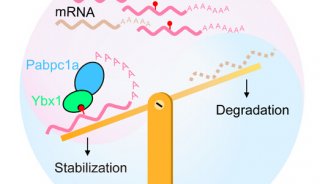
-
实验室动态
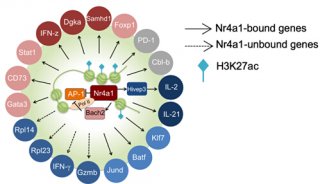
-
焦点事件

-
科技前沿
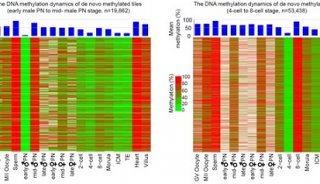
-
焦点事件