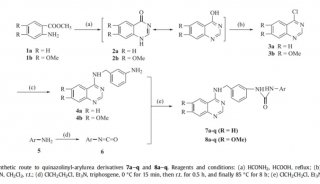
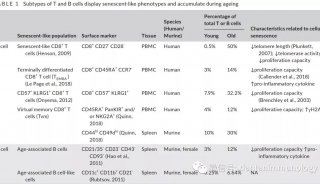
张宏Cell子刊发文 解析自噬降解
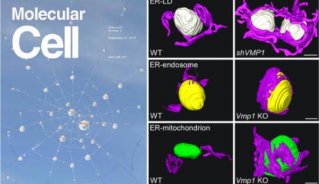
12月17日,中国科学院生物物理研究所张宏课题组和日本微生物化学所Nobuo N. Noda课题组合作,在国际刊物《分子细胞》(Molecular Cell)上,在线发表了题为Structural basis of the differential function of the two C. elegans Atg8 homologs, LGG-1 and LGG-2, in autophagy的研究论文,揭示了线虫中两个Atg8的同源基因LGG-1和LGG-2在蛋白聚集体自噬降解中的不同功能。
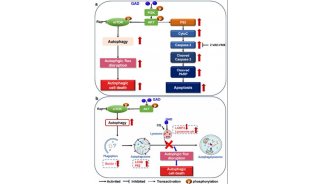
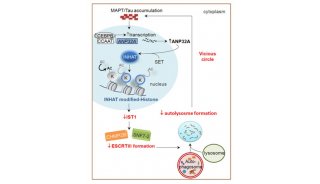
细胞自噬(autophagy)是一种自噬小体介导的细胞降解途径。自噬过程包括自噬小体的形成、延伸、闭合以及与溶酶体的融合。目前研究发现,自噬可以选择性地识辨并降解蛋白聚集体。ATG8-PE泛素系统在自噬小体的形成过程中具有核心的作用。ATG8-PE可以与自噬受体蛋白(如p62和NBR1)相互作用,进而招募特异降解的蛋白底物。高等动物中的自噬过程比单细胞酵母中要复杂得多,一方面是由于酵母中的一个自噬基因在高等动物中有多个同源基因发挥类似的功能,另一方面是由于高等动物又进化出了一系列特异的自噬基因,如张宏课题组前期鉴定的EPG基因。多细胞生物至少存在着七个酵母ATG8基因的同源物,都属于LC3和GABARAP/GATE-16家族蛋白。但它们在不同的发育时期参与细胞自噬各阶段的功能仍然未知。
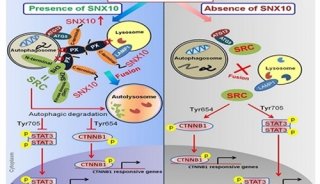
在此研究中,张宏等对线虫中两个Atg8的同源基因LGG-1和LGG-2进行了结构和功能上的研究。不同于lgg-1在蛋白聚集体自噬过程中的不可或缺,lgg-2表现出了不同降解底物的特异性和不同发育阶段的特异性。LGG-1和LGG-2可以与不同的细胞自噬底物和自噬蛋白相互作用,这些互作蛋白几乎都含有LIR motif。基于LGG-1和LGG-2结构的差异,它们对不同类型的LIR motif存在特异的偏向性,并确保了自噬蛋白被招募的先后顺序,进而决定了它们在自噬降解作用的不同步骤发挥作用。
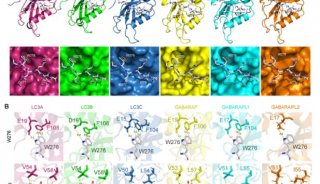
LGG-1和LGG-2有两个疏水口袋,W位点和L位点,这两个位点可以识别Atg8结合蛋白的LIR结构域。通过对比,张宏等发现,LGG-1和LGG-2的W位点和L位点有显著差异,它们识别不同的LIR结构域,进而结合不同的Atg8结合蛋白。他们还发现,LGG-1和LGG-2的氨基端分别呈现闭合构象和开放构象,氨基端的差别也导致了它们在介导膜锚定和膜融合上的活性差异。
LGG-1和LGG-2在自噬过程中的功能差异,为科学家研究哺乳动物细胞中GABARAP和LC3家族蛋白在自噬通路中功能的异同提供了线索。以往人们认为参与自噬作用的同源基因参与不同自噬底物的降解。但张宏等的研究表明,多细胞生物中,自噬基因还会表现出不同降解底物的特异性和不同发育阶段的特异性。
张宏和Nobuo N. Noda是本文的通讯作者。张宏课题组的博士吴凡完成了本课题的大部分工作;Noda课题组的博士Yasunori Watanabe和冯巍课题组的博士生齐欣解析了多个LGG-1和LGG-2的晶体结构;胡俊杰课题组的博士生郭向阳完成了膜锚定和融合的实验;他们被列为共同第一作者。
该项目得到了国家自然科学基金、科技部重大科学研究计划、日本优先领域科学研究资助项目,以及霍华德•休斯医学研究所青年科学家奖的资助。
LGG-1和LGG-2在结构上的差异以及LGG-2表现出降解底物特异性和发育阶段特异性
-
焦点事件

-
科技前沿
-
焦点事件

-
科技前沿

-
项目成果

-
焦点事件

-
综述
-
科技前沿

-
焦点事件

-
科技前沿

-
焦点事件

-
科技前沿
-
科技前沿
-
科技前沿

-
科技前沿
-
科技前沿

-
科技前沿

-
技术原理
-
技术原理

-
技术原理
-
项目成果

-
技术原理

-
产品技术

-
项目成果

-
项目成果

-
焦点事件

-
项目成果
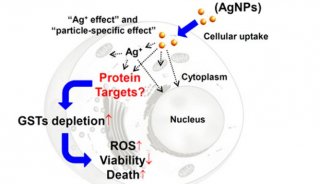
-
项目成果
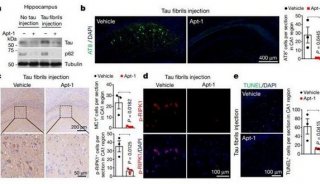
-
焦点事件

-
项目成果
-
项目成果
-
焦点事件

-
项目成果
-
项目成果
-
焦点事件

-
项目成果
-
项目成果
-
项目成果
-
项目成果

-
项目成果
-
项目成果
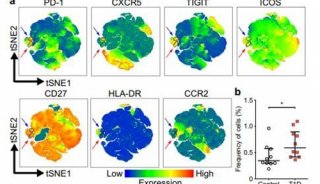
-
项目成果
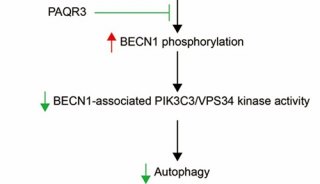
-
项目成果
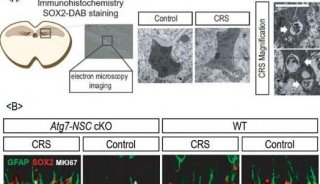
-
项目成果

-
科技前沿
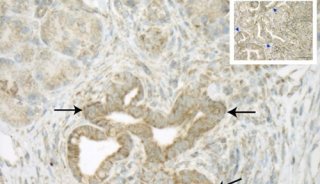
-
科技前沿
-
项目成果
-
项目成果

-
科技前沿
-
科技前沿
-
科技前沿
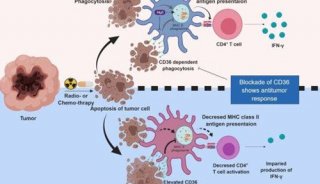
-
项目成果

-
项目成果
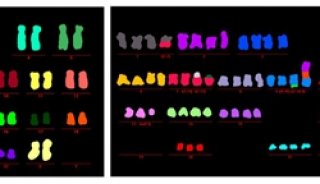
-
科技前沿

-
焦点事件

-
项目成果
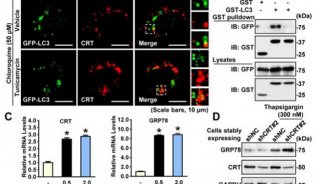
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
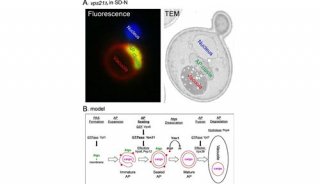
-
项目成果
-
项目成果
-
焦点事件
-
焦点事件

-
项目成果
-
焦点事件

-
项目成果
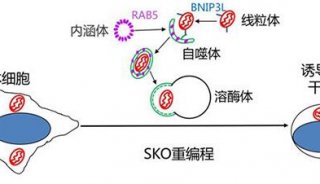
-
科技前沿
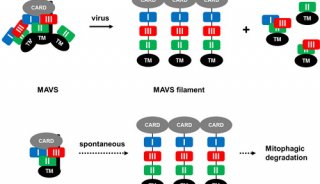
-
项目成果
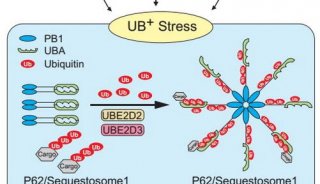
-
焦点事件

-
产品技术

-
精英视角

-
精英视角
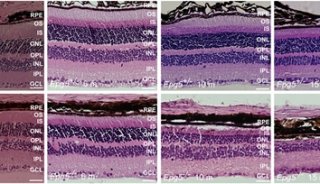
-
其它新闻

-
项目成果
-
项目成果
-
焦点事件

-
实验室动态
-
焦点事件