PNAS发表再生医学新突破
来自麻省总医院(MGH)的研究人员利用人类诱导多能干细胞(iPSCs)衍生的血管前体细胞,在动物模型中生成了功能性的血管,这些血管维持了长达9个月。在发表于《美国科学院院刊》(PNAS)杂志上的研究报告中,研究人员描述了利用来自健康成人以及1型糖尿病个体的iPSCs,在小鼠大脑外表面或皮肤下生成血管的过程。
论文的共同资深作者、麻省总医院Steele 肿瘤生物学实验室主任Rakesh Jain 博士说:“发现让成熟细胞恢复到可分化为多种不同组织类型的‘干细胞样’状态的新方法,为细胞再生医学带来了巨大的潜力,但如何将这些iPSCs衍生为功能性的细胞仍然是一个极大的挑战。我们的研究小组开发了一种有效的方法,利用人类iPSCs生成了血管前体细胞,然后再利用这些细胞在活体小鼠中构建出了工程血管网络。”
能够再生或是修复血管对于治疗心血管疾病和其他由血管损伤引起的疾病,如糖尿病血管并发症等具有极其重要的意义。此外,还可为新生组织提供血管供应,这是当前致力于通过组织工程学构建出实体器官所面临的最大障碍之一。
以往的一些研究成功利用iPSCs生成了构建血管所需的内皮细胞,但将这些细胞导入到动物模型中却无法形成持久的血管。“在这一项目的早期阶段,我们面临的最大挑战是要建立一种可靠的实验方案来生成内皮细胞系,其可以产生大量的前体细胞,来生成坚固的、耐久的血管,”共同资深作者Dai Fukumura说。
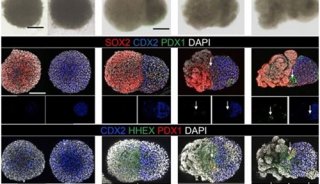
麻省总医院研究小组采用了一种最初用于人类胚胎干细胞(hESCs)衍生内皮细胞的方法。这种方法是利用一个单一的蛋白质标记来鉴别血管祖细胞。而在新研究中,研究人员分选出了不仅表达这一蛋白,还表达另外两种血管潜力蛋白质标记物的iPSC衍生细胞。随后,利用该研究小组成员从前开发的一个可使 hESCs分化为内皮细胞的培养系统扩大了这一细胞群,并证实只有表达三种标记物的iPSC衍生细胞可以生成具有充分潜能形成血管的内皮细胞。
为了检测这些细胞生成功能性血管的能力,他们将表达三种标记物的iPSC衍生内皮前体细胞与间充质前体细胞(可生成必要的结构细胞)一起移植到了小鼠大脑的表面。在两周内,移植细胞形成了血液灌注血管网络,看起来与邻近的天然血管一样发挥了功能,并在活体动物体内持续发挥功能长达280天。当研究人员在小鼠皮肤下移植两种前体细胞群时也生成了功能性的血管,但它需要的移植细胞量增大了5倍以上,并且血管的寿命短,这一结果与该研究小组以往在这两个位点开展的血管生成研究结果相一致。
由于1型糖尿病(T1D)患者常有血管损伤,能够生成新的血管有可能使他们受益,研究人员想要确定由这些患者的细胞衍生的iPSCs,是否能够帮助生成功能性的血管。结果显示,来自健康个体的细胞,以及由1型糖尿病患者iPSCs衍生的前体细胞都能够生成功能性的、持久的血管。但研究人员注意到,不同的T1D-iPSCs细胞系(包括来自同一患者的不同细胞系)在细胞生成潜力上显示出差异,表明还需要更深入地了解潜在的机制。
共同主要作者Rekha Samuel 博士说:“从修复心脏或大脑的损伤血管供应,到阻止糖尿病血管并发症导致的截肢,iPSC生成的血管其潜在应用非常的广泛。但我们首先需要应对诸如 iPSC细胞系差异性等挑战,以及应用这些细胞存在的长期安全性问题,这些也是全世界的科学家们都在致力解决的问题。我们还需要找到更好的方法来操控特定器官和功能所需的特异内皮细胞类型。”