上海生科院揭示泛酸跨膜转运蛋白的结构和分子机理
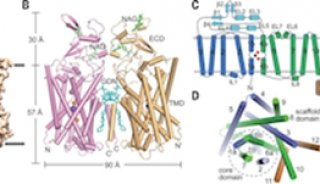
12月15日,PNAS 在线发表了中国科学院上海生命科学研究院植物生理生态研究所张鹏研究组题为Structure of a pantothenate transporter and implications for ECF module sharing and energy coupling of group II ECF transporters 的研究论文。该研究报道了跨膜转运泛酸的能量耦合因子型(ECF, Energy Coupling Factor)转运蛋白的三维结构,揭示了group II ECF转运蛋白多个底物结合蛋白S共享ECF模块的分子机理。
泛酸俗称维生素B5,是生物体中辅酶A合成的前体,是人和动物体维持正常生理功能不可缺少的微量营养素,食物中泛酸的含量丰富。ECF类转运蛋白复合体的功能为跨细胞膜转运包括泛酸、叶酸在内的多种B族维生素和微量元素,存在于多种生物体中。该复合体由细胞膜上底物结合蛋白S和由膜结合蛋白T、胞内ATP结合蛋白A/A’组成的负责能量偶联的ECF模块构成。ECF转运蛋白分为ECF模块专用型(group I)和共享型(group II)两类:前者每一种S蛋白均有各自特定的ECF模块;后者几种不同的S蛋白共享一套ECF模块。ECF转运蛋白的三维结构和跨膜转运的分子机理一直都不清楚。在之前的研究工作中,张鹏课题组解析了叶酸ECF转运蛋白复合体面向细胞内构象的晶体结构,使人们清楚地看到了ECF复合体的三维架构和各组分的作用方式(Xu et al; Nature, 2013);并据此提出了ECF转运蛋白的工作模型:即底物转运很可能通过S蛋白在膜内的翻转来实现(Zhang et al; Trends Microbio, 2013)。然而,人们对ECF模块共享、底物转运等过程的分子机制并不了解。
在该项工作中,张敏华博士和博士生鲍志浩等人在张鹏研究员的指导下,通过解析与叶酸ECF转运蛋白同物种来源的泛酸ECF转运蛋白的结构,以及一系列比较分析和功能实验,揭示了泛酸在转运复合体中S蛋白PanT上的结合位点,以及group II ECF转运蛋白多个底物结合蛋白S共享ECF模块的分子机理:S蛋白上存在一个由跨膜螺旋1、2、6(SM1/2/6)组成的疏水面,不同S蛋白通过这一疏水面与同一T蛋白的CH2/3螺旋(Coupling Helix 2/3)相互作用;T蛋白作为一个介导S蛋白与A/A’蛋白相互作用并传递构象改变的“脚手架”蛋白,自身构象在不同复合体中呈现动态变化,从而保证了其与不同S蛋白的结合。这一研究工作使人们对ECF转运蛋白跨膜转运维生素的过程有了更深入的了解。
该研究得到了国家自然科学基金委、科技部、上海市和中科院的资助。感谢上海光源BL17U线站在实验数据收集中的支持与帮助。
-
焦点事件
-
项目成果
-
科技前沿
-
项目成果