上海生科院发现裂殖酵母端粒结合蛋白Taz1结构
国际学术期刊Cell Research 于6月19日在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所国家蛋白质科学中心(上海)雷鸣研究组的最新研究成果“Fission yeast telomere-binding protein Taz1 is a functional but not a structural counterpart of human TRF1 and TRF2”,发现裂殖酵母端粒结合蛋白Taz1结构和功能上的保守机制。
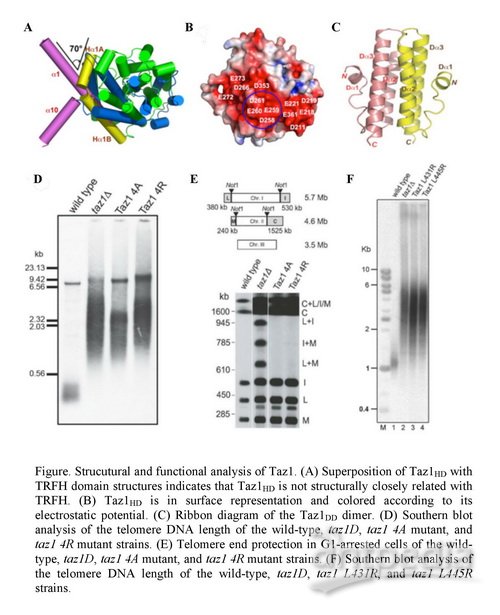
端粒是真核生物染色体最末端的区域,虽然不具备编码蛋白质的功能,但是端粒对染色体的保护功能在基因完整性和细胞生理学其他方面的调节都起着至关重要的作用。端粒长度的异常与癌症及早衰等疾病之间存在密切关联。在哺乳动物细胞中,TRF1和TRF2是最早发现的端粒结合蛋白,包含有一个中心的TRFH结构域和一个碳末端的Myb结构域。TRF1和TRF2各自只含有一个Myb结构域,通过TRFH结构域形成同源二聚体发挥其结合端粒NDA的功能。裂殖酵母Taz1能够结合端粒双链DNA,在裂殖酵母端粒长度调节和保护中发挥重要的作用,被认为是哺乳动物TRF蛋白的功能类似物。然而,Taz1在裂殖酵母中发挥上述作用的结构与功能的分子机制并不清楚。
在该研究中,邓玮等科研人员在研究员雷鸣的指导下,成功解析了Taz1不同结构域的高质量晶体结构。结合遗传学实验结果,他们的研究揭示了Taz1中心的Taz1HD结构域同TRFH结构域之间结构类似但并不相同,也没有形成TRFH中所含有的多肽结合口袋。Taz1并不能够利用Taz1H形成同源二聚体,反而是利用四个a-螺旋所构成的集束(Taz1DD结构域)调节Taz1二聚体的形成。此外,同哺乳动物中的情况类似,Taz1二聚体的形成,对于其在端粒上的定位及端粒长度调节作用的发挥是至关重要的。上述研究成果表明在不同的物种中,端粒结合蛋白具有结构上的可塑性和功能上的保守性,可以通过组合不同的结构元件发挥其保守的生物学功能。
该研究工作受到国家科技部、国家自然科学基金委、中科院战略性先导科技专项(B类)以及HHMI的经费资助。