中山大学教授发表封面文章:癌转移新机制
这一研究成果公布在国际顶尖临床研究期刊Journal Clinical Investigation(IF:12.575)杂志封面上,文章的通讯作者是中山大学附属第一医院转化医学研究中心主任王敏教授,王教授长期从事炎症及血管生物的信号传导通路的基础研究,在炎症、新生血管的信号传导途径及抗炎、抗新生血管的研究中取得许多重要的发现。
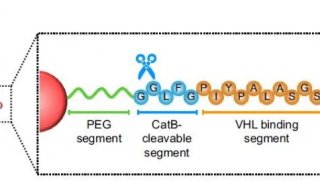
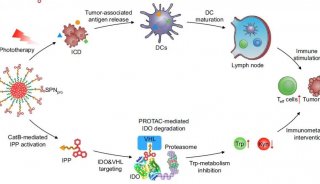
JCI封面图解:巨噬细胞(绿色)位于球体中央、分泌因子激活肿瘤细胞(红色)的增殖和分化并促使肿瘤细胞与巨噬细胞的相关联。去除巨噬细胞、药物阻滞EGFR或者以抗体中和ICAM-1后将阻碍球体形成及卵巢癌进展。
卵巢癌作为发病率排名第二的妇科肿瘤,因缺乏早期诊断标记物以及特异性诊断指标等因素,确诊常在肿瘤种植转移的进展阶段,且尚未研发出特定的靶向治疗药物,死亡率居首位。近10年,该疾病患者5年生存率提升不足2%,远远落后于其他肿瘤诊治研究的发展。
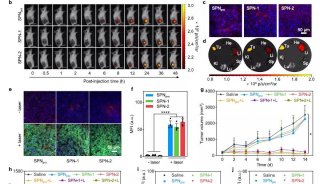
这项最新研究证实了肿瘤与巨噬细胞形成的球状体与卵巢癌临床病理间有紧密联系,通过临床标本以及小鼠卵巢癌模型发现了巨噬细胞在卵巢癌种植转移早期具有促进球体形成和肿瘤生长的作用,揭示了巨噬细胞介导球体形成的新机制,该研究成果为卵巢癌的靶向治疗研究提供新的思路。
作者简介:
王敏
博士生导师,长期从事炎症及血管生物的信号传导通路的基础研究,在炎症、新生血管的信号传导途径及抗炎、抗新生血管的研究中取得许多重要的发现。在Nature Biotechnology,JCI,JEM, Science Signaling, Cell, PNAS等国际著名期刊发表论文80余篇。近五年发表论文36篇,其中通讯作者22篇,影响因子高于10的13篇;多次作为特邀演讲嘉宾参与并主持国际学术会议。
研究方向:炎症和血管生物学研究
主要教育和工作经历:1984年6月毕业于武汉大学,获微生物学学士学位;1989年6月毕业于中科院上海细胞生物学研究所,获细胞生物学硕士学位;1993年6月毕业于英国威尔士大学,获分子生物学和遗传学博士学位;1993年7月至1997年7月在耶鲁大学从事博士后研究,1999年至2014年先后在罗彻斯特大学和耶鲁大学担任助理教授、副教授、终身教授。2014年4月作为中山大学“百人计划”领军人才引进至中山大学附属第一医院工作,任转化医学研究中心主任。
社会兼职:美国耶鲁大学医学院病理系研究生招生委员会主任,耶鲁大学病理学研讨会召集人,美国国立卫生研究院(NIH)研究部(AICS)常务委员,美国NIH基金评审专家,美国NIH “肿瘤微环境”特别成员,美国心脏协会(AHA)国家基金评审专家;Arteriosclerosis, Thrombosis, and Vascular Biology , Frontiers in Physiology, World J Exp Medicine杂志编委,Science,Nature Medicine, J. Clin. Invest.,Oncogene,Angiogenesis, Cancer Research等杂志审稿人。
原文摘要:
Tumor-Associated MacrophagesDrive Spheroid Formation During Early Transcoelomic Metastasis of Ovarian Cancer
Tumor-associated macrophages (TAMs) can influence ovarian cancer growth, migration, and metastasis, but the detailed mechanisms underlying ovarian cancer metastasis remain unclear. Here, we have shown a strong correlation between TAM-associated spheroids and the clinical pathology of ovarian cancer. Further, we have determined that TAMs promote spheroid formation and tumor growth at early stages of transcoelomic metastasis in an established mouse model for epithelial ovarian cancer. M2 macrophageClike TAMs were localized in the center of spheroids and secreted EGF, which upregulated αMβ2 integrin on TAMs and ICAM-1 on tumor cells to promote association between tumor cells and TAM. Moreover, EGF secreted by TAMs activated EGFR on tumor cells, which in turn upregulated VEGF/VEGFR signaling in surrounding tumor cells to support tumor cell proliferation and migration. Pharmacological blockade of EGFR or antibody neutralization of ICAM-1 in TAMs blunted spheroid formation and ovarian cancer progression in mouse models. These findings suggest that EGF secreted from TAMs plays a critical role in promoting early transcoelomic metastasis of ovarian cancer. As transcoelomic metastasis is also associated with many other cancers, such as pancreatic and colon cancers, our findings uncover a mechanism for TAM-mediated spheroid formation and provide a potential target for the treatment of ovarian cancer and other transcoelomic metastatic cancers.