上海有机所在中环化合物的不对称合成方面取得进展
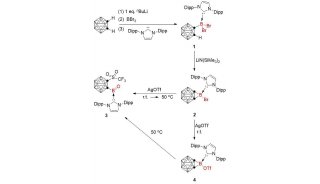
环状化合物在现代有机化学中占有着重要的地位。环状结构广泛存在于各种天然产物和具有重要生理活性的分子中,因此,对于这类化合物的合成是极其重要的。到目前为止,化学家们已经发展了大量的方法合成小环化合物(三—六元环),例如Diels–Alder反应和其它环加成反应等。对于大环化合物(≧十元环)同样也有很多合成方法,例如Corey–Nicolaou大环内酯化反应、Keck大环内酯化反应和烯烃复分解反应等。然而对于中环化合物(七—九元环)的合成,尤其是通过不对称催化的方式合成,至今仍然是一个巨大的挑战。这主要是由于中环合成中存在着不利的跨环张力和熵效应。
中国科学院上海有机化学研究所金属有机化学国家重点实验室研究员游书力团队一直致力于铱催化的不对称烯丙基去芳构化反应研究(Acc. Chem. Res. 2014, 47, 2558)。2013年,他们发现通过铱催化的分子内不对称烯丙基去芳构化/迁移反应可以高对映选择性地实现多环吲哚(吡咯)结构的构建(J. Am. Chem. Soc. 2013, 135, 8169)。2015年,他们使用类似的策略完成了螺环吲哚啉类化合物的不对称合成。值得注意的是,当吲哚2位带有取代基时,反应中生成的螺环中间体可以通过逆Mannich/水解反应得到手性色胺衍生物(Angew. Chem., Int. Ed. 2015, 54, 14146)。
基于对该类反应机理的深入理解,最近该小组发展了一种新型的不对称催化的方法,用于合成吲哚并中环化合物(J. Am. Chem. Soc. 2016, DOI: 10.1021/jacs.6b02678)。通过向吲哚的2,3位引入六元或者七元并环,可以有效地实现分子内反应位点的预组织。在铱催化下首先进行不对称烯丙基去芳构化反应得到桥环中间体,再经历逆Mannich/水解反应得到七—九元环产物。对关键桥环中间体的原位捕捉实验对这一反应机理提供了佐证。该反应条件温和、底物普适性广,为吲哚并中环化合物的合成提供了一条高效的途径,对于含中环结构药物的设计和发现具有重要的意义。该研究工作发表后受到了美国化学会《化学与工程新闻》周刊(Chemical & Engineering News)的关注,5月9日出版的最新一期杂志以Asymmetric third ring is a charm for indole-annulated compounds 为题对该工作进行了介绍。
上述研究工作得到了国家自然科学基金委、科技部、中科院和上海市科委的大力资助。
-
科技前沿

-
项目成果
-
科技前沿
-
产品技术

-
科技前沿

-
科技前沿
-
科技前沿
-
项目成果
-
项目成果

-
项目成果
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
企业风采

-
会议会展

-
技术原理
-
技术原理

-
技术原理