研究发现蛋白变形导致疾病差异
俗话说一颗老鼠屎坏了一锅粥,大脑中的一些异常蛋白就是这样。这些折叠错误的蛋白,会使其附近的蛋白也发生错误折叠。日前,NIH资助的一项新研究显示,一种蛋白能够形成多个异常形态,对其他蛋白产生不同模式的影响,从而导致相应的神经性疾病。发表在本期Cell杂志上的这项研究,为治疗帕金森症和其他神经退行性疾病,带来了重要的启示。
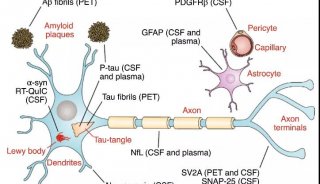
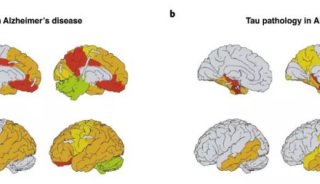
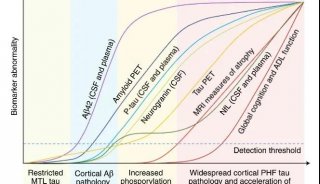
α-突触核蛋白在脑细胞中累积,会引发突触核蛋白病(synucleinopathy)、多系统萎缩、帕金森症、帕金森病痴呆PDD和Lewy痴呆DLB等疾病。在这些疾病中,有时也会出现其他错误折叠蛋白的累积。例如,PDD和DLB患者的大脑中,往往会出现tau蛋白形成的缠结,而这本是阿尔茨海默症的标志。这项新研究指出,特定形态的α-突触核蛋白,在PDD和DLB患者的大脑中,引起了突触核蛋白与tau蛋白的同时累积。
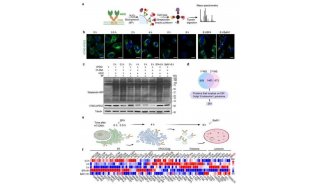
Jing L. Guo博士及其同事在体外制备了不同结构的α-突触核蛋白纤维,并在细胞实验和小鼠实验中,分析这些α-突触核蛋白的作用。他们发现,α-突触核蛋白的两种结构,在神经元中的活性大不相同:一种(strain A)只引起α-突触核蛋白的累积,而另一种(strain B)使α-突触核蛋白和tau蛋白同时累积。
研究人员构建了能合成大量人类tau蛋白的小鼠模型,并将上述两种α-突触核蛋白注入到小鼠大脑。随后,他们选取不同的时间点,监测α-突触核蛋白和tau蛋白的累积情况。研究显示,与注射strain A的小鼠相比,注射了strain B的小鼠脑部,tau蛋白累积更为显著,不仅时间更早而且跨越了更多的大脑区域。
研究人员还检测了五位PDD患者的大脑样本,其中有些患者同时患有阿尔茨海默症。他们发现这些样本中存在两种不同结构的α-突触核蛋白,一种存在于PDD患者的大脑,一种存在于PDD/阿尔茨海默症患者的大脑。
这项研究中的两种α-突触核蛋白是人工合成的,不过作者们强调,人类的大脑环境非常复杂,更有机会形成多种结构的α-突触核蛋白。“这些结构异常的蛋白,不仅能将细胞中的正常α-突触核蛋白转变为致病蛋白,还能在细胞间传播,并同时改变其结构形态。而新的结构形态,可以赋予α-突触核蛋白损害其他蛋白的能力,”文章的资深作者Virginia M.Y. Lee博士说。
-
科技前沿
-
项目成果
-
焦点事件

-
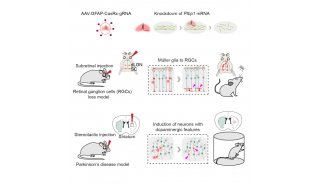
项目成果
-
项目成果