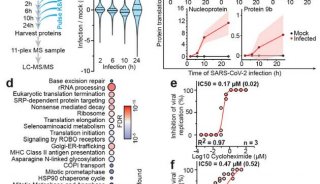
《JCB》:P53抑癌基因关闭侵袭性癌症细胞
报道:Ras是人类癌症基因中最容易突变的基因之一,因此发展以Ras信号转导通路为靶点的抗肿瘤抑制剂具有很好的药学前景。在所有的人类肿瘤细胞中,Ras基因的变异占20%~30%,Ras变异发生率最高的是胰腺癌(90%),其次为结肠癌(50%)和肺癌(30%)。推荐阅读:新晋院士Cell解析致癌基因新功能。
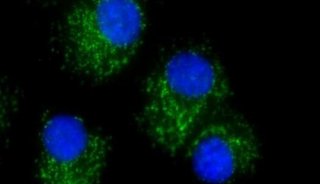
肿瘤抑制基因p53对于Ras驱动的细胞侵袭具有抑制作用,但是其根本机制仍然知之甚少。2014年3月24日发表在国际知名学术期刊《细胞生物学》(The Journal of Cell Biology)的一项最新研究表明,p53可通过激活一种线粒体蛋白酶让其裂解β-肌动蛋白,并限制创膜突起(invasive membrane protrusions)的形成,阻止癌症细胞的入侵。
新加坡国立大学力生物学研究所的Keiko Kawauchi解释说:“大多数研究都集中在,p53如何通过调节上皮间质转换(EMT)来阻止转移。相反,对于p53如何影响驱动细胞入侵的细胞骨架过程,还知之甚少。”因此,在Shota Yamauchi的指导下,Kawauchi及其同事比较了有野生型p53和无野生型p53的Ras转化成纤维细胞。与p53缺失细胞相比,表达p53的转化成纤维细胞侵袭性更低,与胞外间质之间形成更少的粘着斑。p130Cas是一种粘着斑信号蛋白,可促进板状伪足膜突起(lamellipodial membrane protrusions)形成和癌细胞浸润。在p53阳性细胞内较少磷酸化,这表明p53肿瘤抑制基因通过下调该蛋白的活性,限制了细胞的入侵。事实上,敲除p130Cas可抑制缺乏p53的Ras转化成纤维细胞入侵。
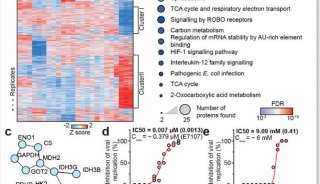
研究人员发现,至于其它的粘着蛋白,肌动蛋白聚合增强了p130Cas的磷酸化作用。肌动蛋白解聚药物细胞松弛素D可减少p130Cas磷酸化作用,而利用jasplakinolide(是一种海绵Jaspis johnstoni的大环肽天然产物,可诱导肌动蛋白聚合成微丝,即F-肌动蛋白)稳定肌动蛋白丝则具有相反的作用。在有野生型p53存在的情况下,致癌基因Ras可通过诱导β肌动蛋白的溶蛋白性裂解,降低F-肌动蛋白的水平,从而减少p130Cas磷酸化。Ras转化成纤维细胞——缺乏p53或表达肿瘤抑制剂的一个显性负版,没有表现出F肌动蛋白水平或p130Cas的这种降低。
然后,研究人员调查了哪一种蛋白酶能靶定β肌动蛋白。Kawauchi称:“Caspase-3和线粒体蛋白酶HtrA2已被证明能裂解β肌动蛋白。Caspase-3并不是由Ras 转化所激活,所以我们将重点集中在HtrA2。敲除或抑制这个蛋白酶,可抑制β肌动蛋白裂解,增强Ras转化的p53阳性成纤维细胞的侵袭。”
HtrA2通常位于线粒体的间隙,但是p53过表达可诱导这种蛋白酶释放到细胞质中。然而,即使在缺乏p53的细胞内,致癌基因Ras也可通过刺激线粒体裂变,诱导HtrA2的释放。那么p53的作用是什么?研究人员发现,该肿瘤抑制基因通过促进线粒体内HtrA2的活性,降低肌动蛋白水平并抑制细胞入侵,因此蛋白酶可以有效地裂解β肌动蛋白。MAP激酶p38对于这一活化步骤非常关键。Kawauchi解释说:“p53基因促进p38到线粒体的易位,因此MAP激酶能够磷酸化并激活HtrA2。”
P53可通过降低Ras转化成纤维细胞边缘附近的线粒体内膜电位,来促进p38到线粒体的易位。Ras可诱导p53在细胞质中积累,使肿瘤抑制基因刺激p38输入和HtrA2激活,然后RAS诱导的线粒体分裂,β肌动蛋白裂解。Kawauchi称:“F-肌动蛋白减少,可抑制p130Cas信号,所以肌动蛋白重塑是阻止细胞侵袭的一个信号。”
现在,Kawauchi及其同事想探讨p53如何降低周围线粒体的膜电位。她说:“p53如何调节线粒体电位的局部变化?这对于我们来说将是重要的发现。”
-
项目成果
-
项目成果
-
焦点事件
-
科技前沿

-
科技前沿
-
科技前沿
-
企业风采

-
科技前沿

-
科技前沿

-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
焦点事件

-
焦点事件

-
科技前沿
-
项目成果

-
项目成果
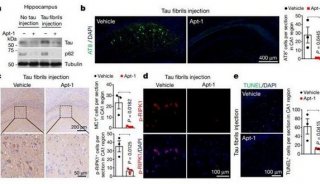
-
项目成果
-
焦点事件

-
焦点事件

-
项目成果
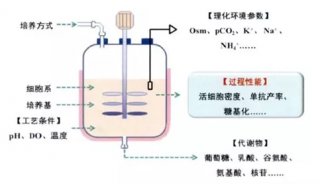
-
项目成果
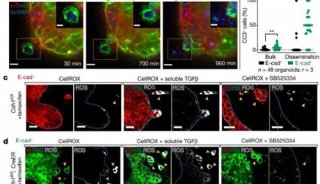
-
科技前沿
-
项目成果
-
焦点事件