复旦大学特聘教授Cell子刊发表免疫学新成果
近日来自北卡罗莱纳大学和复旦大学的研究人员,描绘出了分子水平上炎症控制蛋白复杂的相互作用。研究论文发表在2月21日的《Cell Reports》杂志上。
领导这一研究的是北卡罗莱纳大学Lineberger综合癌症中心成员、生物化学和生物物理学副教授陈先(Xian Chen)。其主要从事定量蛋白质组学研究,曾独立地有创新性地发展了生物质谱技术,大大地提高了其在基因功能组及蛋白质组研究中的特征性。荣获美国总统早期成就青年科学家奖。现为教育部长江学者,复旦讲座特聘教授。
炎症反应是免疫系统的第一道防线。在这一过程中会生成细胞因子控制感染,防止恶性肿瘤等疾病发生或扩散。在疾病相关炎症反应过程中,细胞因子生成过量或不足可以导致多种疾病,如关节炎、哮喘和某些种类的癌症等。
研究小组发现,在耐受内毒素(LPS)持续刺激的巨噬细胞中,蛋白磷酸酶PP2Ac可组成性激活,并靶向Toll样受体衔接蛋白MyD88。
陈先说:“在内毒素耐受的巨噬细胞中,PP2Ac被组成性激活,对某一将促炎MyD88转变为免疫抑制MyD88的开关起作用。”
通过研究潜在于炎症下的蛋白质网络互作,研究人员发现PP2Ac可破坏由MyD88和TLR4介导的促炎性信号。由此,组成性激活的PP2Ac和MyD88移动到细胞核中,与表观遗传机器结合,改变一种促炎基因的染色质结构,导致这种基因沉默。
“在细胞核内,组成性激活的PP2Ac以一种MyD88依赖性方式,重编程了表观遗传机器,”陈先说。
发现PP2Ac的行为,陈先研究小组确立了细胞信号传导与表观遗传调控之间从前未知的一种联系,它影响了炎症的遗传蓝图。通过绘制这一信号通路,以及在慢性炎症下细胞内异常激活PP2Ac靶向的表观遗传机器,研究小组确定了未来治疗炎症相关疾病和癌症的潜在免疫调节靶点。
“我们不仅确定了单个的靶点,还确定了动态蛋白质互作网络中那些相互关联的靶点。一些靶点作用于单基因,一些靶点则具有脱靶副效应,了解这些将为未来的网络医学打下基础。为了提高药物靶点的精确性,我们会致力揭示作为靶点单个的蛋白以及它们之间的相互作用,”陈先说。
-
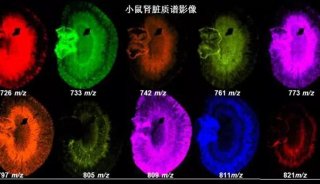
产品技术
-
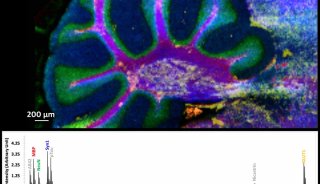
企业风采

-
企业风采
-
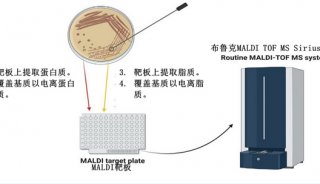
综述
-
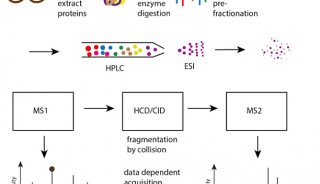
财报

-
企业风采

-
企业风采

-
技术原理

-
焦点事件
-
焦点事件

-
综述