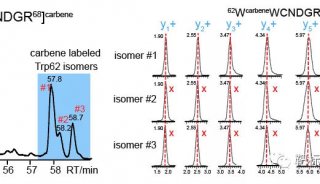
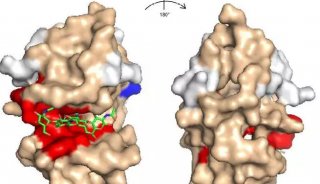
清华大学同期发表2篇PNAS新文章
来自清华大学生命科学学院的两个研究小组分别在IL-33与受体结构分子学和亨廷顿病研究中取得突破性进展,两篇研究论文于8月26日共同发表在《美国科学院院刊》(PNAS)杂志上。
在第一篇题为“Structural insights into the interaction of IL-33 with its receptors”的论文中,研究人员解析了IL-33与其受体相互作用的结构机制。
清华大学生命科学学院的王新泉(Xinquan Wang)教授和台湾国立成功大学的王淑莺(Shuying Wang)助理教授是这篇论文的共同通讯作者。王新泉教授的主要研究方向为细胞因子特异结合并激活其受体分子,以及病原体逃避宿主免疫攻击的结构机理。
IL-33是IL-1家族的一个重要成员,在宿主防御及疾病的先天和适应性免疫反应中发挥着多效活性。IL-33通过它的配体结合主要受体ST2和IL-1受体辅助蛋白(IL-1RAcP)来发送信号,这两种受体均为IL-1受体家族成员。
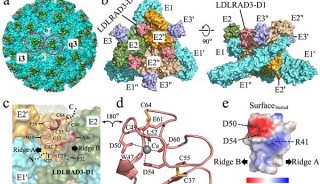
为了阐明IL-33与它的受体之间的相互作用,研究人员确定了分辨率为3.27 Å的IL-33与ST2胞外域构成复合物的晶体结构。采用结构诱变和结合分析,得到的结构分析结果确定了ST2特异性识别IL-33的分子机制。研究人员将之与IL-1家族中的其他配体-受体复合物进行结构比较,证实表面电荷互补至关重要地决定了IL-1主要受体的配体结合特异性。
结合晶体学和小角度X射线散射研究揭示,ST2在D3结构域和D1D2模块之间具有柔性铰链,而IL-1RacP在溶液中以一种游离状态显示刚性构象。ST2的分子灵活性提供了关于IL-1主要受体与配体结合时结构域层次构象变化的结构认识。IL-1RacP的刚性则解释了它为何不能直接配体的原因。小角度X射线散射分析溶液中IL-33–ST2–IL-1RacP复合物的结构,结果与IL-1β–IL-1RII–IL-1RacP和IL-1β– IL-1RI–IL-1RacP的晶体结构相似。
这些研究结果阐明了IL-33结构与功能的关系,支持并扩展了IL-1家族中配体-受体组装和激活的普遍模型。
在第二篇题为“Huntington disease arise from a combinatory toxicity of polyglutamine and copper binding”的论文中,研究人员证实亨廷顿病是由于铜结合与多聚谷氨酰胺(polyQ)双重组合毒性所导致。
领导这一研究的是清华大学生命科学学院的周兵(Bing Zhou)教授。他的主要研究兴趣包括有青蒿素的作用机制,金属离子代谢和神经退行性疾病,酵母死亡的基因调控。
亨廷顿病(Huntington disease,HD)是由于huntingtin (Htt)蛋白N末端多聚谷氨酰胺(polyQ)扩增所引起的一种渐进性神经退化性疾病。多年来研究报告证实HD患者的纹状体有异常的金属累积,但直到现在也还未确立它的因果关系。如果金属确实参与了亨廷顿病,有必要探索它的潜在机制。
在这篇文章中,研究人员通过将带有扩增polyQ的Htt exon1(Htt exon1-polyQ)导入到果蝇中,构建出了一种亨廷顿病果蝇模型。他们证实与铜代谢相关的基因表达发生改变,可显著调控HD的进展。干预饮食铜水平也能够改变果蝇的HD表型。铜减少可很大程度上降低寡聚化和聚集Htt的水平。令人惊讶的是,研究人员证实置换Htt的两个潜在铜结合残基Met8和 His82,可完全解离铜增强Htt exon1-polyQ毒性的效应。
这些结果表明HD承受了双重水平的毒性:铜通过直接结合exon1促进了蛋白质积聚,以及铜非依赖性的polyQ毒性。这两条平行的信号通路结合导致了Htt毒性,表明理想的HD治疗应该是将这些作用均考虑在内的一种组合策略。
-
市场商机

-
项目成果
-
科技前沿
-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿
-
科技前沿

-
科技前沿

-
科技前沿

-
技术原理

-
项目成果
-
项目成果
-
焦点事件

-
焦点事件

-
综述
-
焦点事件

-
项目成果
-
项目成果
-
科技前沿