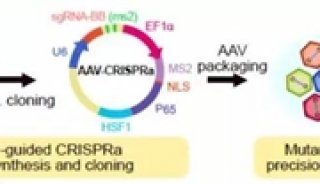
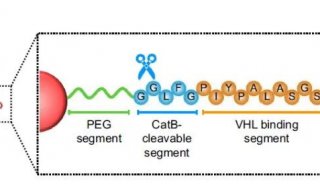
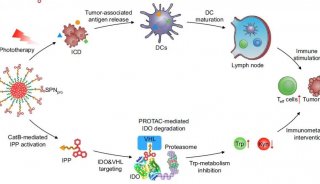
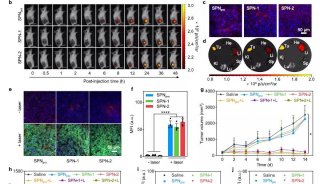
癌症研究新方向 科学家尝试用组合式靶向疗法剿灭癌症
我们总是对患者说癌症会以达尔文的自然选择方式在体内进化,但是我们并没有足够的证据证实这一点。
大约在2010年,Alberto Bardelli跌入了科研低谷。Bardelli是意大利都灵大学癌症生物学家,他一直在研究癌症靶向疗法——针对导致肿瘤生长的突变的药物。这种方法的效果似乎很好,一些患者开始逐渐康复。但随后未能避免的是,患者的肿瘤开始对药物产生耐药性。随着时间的发展,Bardelli将会看到癌症重新复发。“我碰到了一堵墙。”他说。Bardelli意识到,问题并不在于具体的突变,而是进化本身。“不幸的是,我们面对的是地球上最强大的力量之一。”他说。
研究人员一直认为肿瘤会进化。随着它们的发展会产生突变,并出现大量存在基因差异的细胞。这些细胞会对抗癌药物产生耐药性,并幸存下来继续扩散。似乎不管医生用什么药物,肿瘤最终都会适应。研究人员很难打破这一过程,因为随着时间的发展,癌症会在人体内进化。“我们总是对患者说癌症会以达尔文的自然选择方式在体内进化,但是我们并没有足够的证据证实这一点。”英国伦敦弗朗西斯·克里克研究所癌症研究者Charles Swanton表示。
癌细胞存在着大量惊人的突变。2012年,Swanton和同事对患有肾癌的两名患者进行了多个活检,他们发现即便是在同一个人体内,也不存在同样的样本。该团队不仅检测了主要的肿瘤,还有扩散到患者身体其他部位的卫星肿瘤(即转移性肿瘤)。研究人员在每名患者的各种肿瘤样本中发现了100多种突变,其中仅有1/3的突变在所有样本中存在共性。
现在,针对一些树干发生的肿瘤突变治疗已经存在,它们一开始往往会产生显著的免疫应答效应。但正如Bardelli所发现的那样,其随后就会产生耐药性。“我们通常会关注‘肿瘤变得越来越小’,但是却没有考虑后面留下了什么。”Swanton说,“留下的经常是难以治愈的耐药性克隆体。”但他认为,通过同时靶向多个树干突变,研究人员或许能够有机会消灭癌症。一个癌症细胞能够接二连三地逃避攻击的机会很小。
这项研究仍处于婴儿期,但Swanton正在带领一项有助于确认其发现的临床研究。这项叫作TRACERx(通过治疗跟踪癌症演化)的研究将跟踪850名肺癌患者的诊断和治疗过程,乃至死亡。它将记录随着时间流逝,肿瘤的基因变化,包括肺癌如何发展,相关治疗如何影响其发展等。一旦获得数据,Swanton希望能够筹集到足够资金,测试基于肿瘤细胞进化的治疗策略。
采用革命性的方式或许能够帮助免疫系统消灭肿瘤。美国佛罗里达州莫非特癌症研究中心分子肿瘤学家Robert Gatenby有着更加谨慎的目标:他希望帮助患者可以带病生存。他看到很多人治疗后复发,认为癌症似乎不是一种生物学问题,而更像一种巫术。“它就像一个邪恶的东西,会不断出现,毁灭你所做的所有工作。”但是当他开始从进化论的观点思考癌症时,问题开始变得易于处理。
然而,近年来的研究表明,在遇到相关疗法之前,肿瘤就会潜伏在耐药细胞内。耐药细胞的数量相对较少,因为耐药性会产生一定代价。然而,当患者收到异常大量的化疗药物后,耐药细胞会比易感细胞变得更加强大。Gatenby把药物的耐药性比作一把伞:“如果在下雨时,这把伞就非常有用;但如果不下雨,它就是负担。”Gatenby认为,通过审慎管理用药剂量或是时间,就能够利用易感细胞和耐药细胞之前的天然竞争关系。
医生已经注意到其他起作用的革命性范式。2016年1月,波士顿马萨诸塞州总医院胸腔肿瘤学家Jeffrey Engelman和同事对一名患有转移性肺癌的52岁女性的病例进行了详细分析,这名女性的肿瘤存在遗传重排,形成了错误版本的ALK蛋白,因此医生首先给她开了克里唑蒂尼,这种药物能够抑制ALK的活性。患者产生了较高的反应,但随后却复发了。第二轮的疗法随后也失败了,因此医生转向了目前正在临床验证阶段的第三种疗法。这种疗法在一段时间里起到了作用,但是不到一年,这名女性肝功能出现衰竭,她不得不住院。随后,医生发现第三轮治疗引发了一种新突变,让她的肿瘤又一次对克里唑蒂尼产生应答。当医生对该药物使用进行管理后,她的肝脏恢复了,她很快康复,最后出院。
很难保证这其中任何一种策略会发挥作用。但是即便这项实验失败了,其研究结果也会帮助研究人员精练其理论,并可能解决一些未知的大问题。例如,肿瘤内的基因分化细胞如何发生作用?它们所栖息的细胞环境起到什么样的作用?哈佛大学医学院肿瘤学家Kornelia Polyak说,癌症研究人员倾向于聚焦细胞内的突变,而没有考虑那些变异细胞如何影响周围的细胞。“这是个很大程度上尚未探索的领域。”她说。
肿瘤细胞内的动态状况非常复杂,但是Engelman并未泄气。临床分析将会帮助研究人员理解其中的复杂性。“这些发现将会让我们日益接近越来越大的发现。”他说,“让人沮丧的是不知道到底在发生什么。”
癌症免疫疗法和靶向疗法联合的“前世今生”
近日,来自德克萨斯大学MD安德森癌症中心的研究人员通过研究表示,利用免于免疫系统攻击癌症的药物同基因组靶向疗法相结合或许可以更好地帮助治疗癌症患者。
在过去30年里研究者已经阐明了许多参与癌症发生的分子机制,而同时研究者也鉴别出了许多可以诱发癌症的遗传突变,而针对这些致癌的遗传缺陷的靶向药物被证明在很多患者的初期治疗中是有作用的,比如靶向作用BRAF基因突变的药物在几乎一半的黑色素瘤患者中都可以抑制肿瘤的发生;然而耐药性随之而来,因为肿瘤拥有多种基因组缺失,其就可以帮助肿瘤细胞在药物疗法后产生一种耐药性,BRAF抑制剂在临床试验中可以将患者的生存中值延长至7个月。
研究者Allison提出了“免疫检查点封锁”一说,这是一种治疗免疫系统的方法,通过阻断T细胞上的特殊分子来间接地保护肿瘤细胞免于免疫反应;而一种名为易普利姆玛(Ipilimumab)的药物在抵御恶性黑色素瘤上相比其它靶向药物表现出了较低的免疫反应率,但长期跟踪调查结果显示,22%的治疗患者至少存活了4年,更重要的是那些幸存3年的患者甚至生活超过了10年。
众所周知,免疫系统可以识别癌细胞的特性,并且发动T细胞来攻击肿瘤细胞的抗原,而检查点封锁正好可以移除这种攻击作用;研究者需要理解为何某些癌症患者对免疫疗法没有反应,但是对于其他患者而言反应却是非常明显的。
研究者Sharma指出,多种基因组靶向疗法的结合被证实可以有效抑制癌症,然而很多数据又显示,肿瘤基因组的多样性或许会打败许多组合疗法,而且随着不同药物对患者的施用也会增加更大的副作用。
靶向疗法或许可以扮演一种有效的癌症疫苗,其可以杀灭肿瘤细胞并且释放T细胞最喜爱的靶向抗原来对癌细胞实施打击。研究者的I期试验是将免疫检查点封锁药物同两种靶向疗法相结合,而后期研究者并没有足够的时间来确定个体的生存影响及机体反应的持久性。而在两项临床试验中,研究者将易普利姆玛同两种不同的BRAF抑制剂相结合来阐明联合疗法在治疗黑色素瘤中的作用,在其中一种疗法中肝脏的毒性导致试验终止,而另一种组合疗法随着试验的进行也表现出了较好的耐受性。
研究者表示,这就需要强调药物、剂量以及给药方案的差异,其需要被评估才可以进行不同联合疗法的开发,当前检查点阻断药物主要可以阻断两种“检查点”机制,而研究中发现的其它机制可以同刺激性分子一样来刺激机体产生免疫反应;这就为免疫疗法提供了新的靶点。面对多种可能的药物组合更有效的临床前研究或许可以帮助研究者做出正确合理的选择。
由于大量的资金都投入到了癌症定向的基因组靶向疗法中去,因此研究者不得不暂时搁置免疫疗法的开发;研究者Sharma及其同事倡议,应当投入大量的资源用于进行免疫检查点的疗法研究以及开发具有治愈潜能的靶向免疫组合性疗法。
最后研究者总结道,当前阶段我们可以毫不牵强地说,增加对联合疗法的资助或许是未来开发有效治疗癌症的最佳选择,而研究者也将为了这一目的不断深入研究。
中国研制首台新型癌症检测设备
据报道,武汉光电国家实验室(筹)日前宣布,中国首台人体临床“全数字正电子发射断层成像仪(PET)”研制成功,已进入临床试验阶段。这台拥有完全自主知识产权的人体临床“全数字PET”,空间分辨率等核心指标比国际同类产品提升近一倍,可精准检测到最小尺寸的癌症病灶,大幅提前癌症发现时间,这标志着中国在此项高端医疗仪器领域取得国际领先地位。
该成果由武汉光电国家实验室(筹)研究员、华中科技大学生命科学与技术学院教授谢庆国带领团队完成。据谢庆国介绍,“全数字PET技术”设备由300多个探测模块组成,借助全数字采样和信号处理算法,空间分辨率可达到2.2毫米,患者完成全身检测仅需5分钟,耗时比传统PET设备少一半。
全数字PET技术是继超声、CT和核磁共振之后当今最顶尖的医学影像技术,主要应用在癌症、心血管疾病、神经系统疾病等重大疾病的精准诊断领域。由于涉及核物理、电子、材料、机械、医疗等诸多学科,技术门槛高,目前全球仅3家跨国公司能独立研制生产。中国首台人体临床“全数字PET”的成功研制,有助于打破当前高端医疗仪器市场被进口产品垄断的局面。
【研究】10种“意想不到”的癌症研究新方向
如何靶向杀灭癌细胞呢?科学家们有着不同的方法。近日,发表在国际杂志Cancer Cell上的一项研究论文中,来自卑尔根大学等机构的研究人员发现了一种可以帮助癌细胞扩散的特殊蛋白,那么科学家们就找到了癌细胞的致命要害,通过抑制这种特殊蛋白的活性或许就可以抑制癌症扩散,进而杀灭癌细胞。
那么科学家们还有什么高大上的杀灭癌细胞的方法呢?
【1】新型纳米材料定向爆破癌细胞
对于那些体内已经存在肿瘤的患者,一般会通过手术切除肿瘤。通常在术后,为了巩固手术效果,医生还会根据患者的情况为患者安排化疗或者放疗。但是这种疗法对人体来说会有很大的毒副作用,比较常见的会有脱发、恶心呕吐、食欲不振和白细胞或血小板减少等等,让患者痛不欲生。
美国德州的莱斯大学(Rice University)的一个研究团队决定使用纳米金属粒子来解决这个问题。
研究人员首先利用细胞免疫疗法的原理,找到癌细胞表面的特殊标志物,然后找到相对应的免疫蛋白抗体,将其结合到纳米金属颗粒上,这样的纳米金属颗粒就像长了眼睛一样,专挑癌细胞表面聚集。
由于第一步的精巧设计,大量的纳米金属颗粒会成簇的聚集在癌细胞表面,然后被癌细胞成簇的吞下,而健康细胞里面几乎没有纳米金属颗粒。所以这回只需要使用超短波红外线脉冲即可加热纳米金属颗粒“烫死”癌细胞了。然而,没想到的是,Lapotko团队的这一设计让他们收获了意外的惊喜。这回癌细胞不是被“烫死”的,是被“炸死”的!
【2】阿喀琉斯之踵-GPS定位癌细胞
伦敦大学学院(UCL)的研究人员已经发现了一种寻找癌细胞的新方法:人体可以寻找肿瘤中的特殊标记来确定肿瘤的位置。它有一个神奇的名字——“阿喀琉斯之踵”。
以前,科学家们试图用相同的原理引导免疫系统,来消灭恶性肿瘤,但是这些疗法不太管用,并且让人体的防御机制走向了错误的方向。
癌细胞的不同是导致这一现象的部分原因。实际上,癌细胞经过了极端的突变。这种情况就像是树的“主干”发生了变异,在接下来的细胞复制中又产生了不同的变异,这就是癌细胞的异质性。针对这一现象,新的研究发现了一种寻找“主干”变异的方法,它可以改变抗原,即癌细胞表面嵌入的蛋白质。
定位主干变异细胞有两种方法。第一种方法是为每个病人开发癌症疫苗,训练免疫系统定位癌细胞。第二种方法是”钓出“已经可以定位变异细胞的免疫细胞,在实验室中培养增殖,然后再放回病人的体内。
癌症研究院的马尔科·格林杰博士(Marco Gerlinger)说这项工作非常有趣,但是它的实际运作情况还有待考证。”
【3】32岁科学家发明血液癌细胞透析技术
2016年《麻省理工学院技术评论》评选出的亚洲35位35岁以下科技创新精英(TR35)中,有一位叫Majid Ebrahimi Warkiani获奖者,他研发的新技术将为癌症的诊断和治疗带来新的希望。
Warkiani如今32岁,目前是澳大利亚世界顶尖研究型学府新南威尔士大学(UNSW)的助理教授,他还是UNSW纳米医学中心的项目负责人。
Warkiani的新技术叫“透析癌症”(dialysis for cancer),利用这一技术不仅可以发现早期的癌症,评价癌症的治疗效果,以及对癌症的发展做出判断(即所谓的预后);更重要的是,这项技术还有治疗的作用。这种治疗方法简单易懂,就是直接滤掉血液中的癌细胞,延缓甚至阻止癌症的扩散转移。
一直以来,癌症死亡率居高不下的最主要原因就是癌症的扩散转移。当癌组织成长到一定的程度时,癌细胞会进入癌组织中的血管,成为循环肿瘤细胞(CTCs),这些CTC在寻找到合适的新居所之后,便进入该组织定居。这就是为什么很多人最开始得的是胃癌,最后变成肝癌、肺癌、骨癌,甚至脑癌。实际上目前的放化疗手段也仅仅是将体内的癌细胞控制在一个较低的水平,并不能彻底清除体内的癌细胞。而据Warkiani介绍,“透析癌症”技术可以除掉血液中95%的癌细胞。表明该技术在提高癌症治疗质量,抑制癌症转移方面有巨大应用价值。
癌症研究新方向!科学家尝试用组合式靶向疗法剿灭癌症 科技世界网
【4】自杀式基因疗法杀死前列腺癌细胞
来自美国休斯顿卫理公会医院的研究人员进行了一项长期临床研究,研究结果表明放射治疗结合"自杀基因治疗"技术可以为前列腺癌病人提供安全有效的治疗。"自杀式基因治疗"技术通过对前列腺癌细胞进行基因修饰使得癌细胞向病人免疫系统发送信号实现"自杀"过程。
E.Brian Butler说道:"我们使用腺病毒携带能够产生胸苷激酶(TK)的疱疹病毒基因,直接靶向到肿瘤细胞,一旦基因完成导入就会开始合成TK,在此之后,我们给病人服用一种常用的抗疱疹药物——伐昔洛韦,这样就能够攻击疱疹病毒DNA,使合成TK的肿瘤细胞发生自我摧毁,所以我们把这项技术称作'自杀式基因疗法'。"
Butler表示,一旦伐昔洛韦开始攻击肿瘤细胞,它就会唤起病人的免疫系统,对癌细胞发起总攻。
根据这项研究的结果,将基因疗法与放射治疗结合使用,无论是否进行激素治疗,都非常具有应用前景。除此之外,使用联合治疗方法的病人各项参数均好于单独使用放射治疗的病人,研究人员表示,大部分参与研究的病人基本没有出现副作用,目前III期临床试验正在进行,在得到FDA批准之前仍然需要对该方法的安全性和有效性进行进一步评估。
【5】新研究用热激活“手榴弹”定点摧毁癌细胞
来自曼彻斯特大学的研究人员之前开发出小的膜泡样脂质体可以用来装载癌症治疗药物并将药物转运到癌细胞内,但是与其他治疗方法所面临的问题相同,如何将脂质体直接导向到肿瘤进行药物投递同时不影响健康组织是这一技术所面临的重要挑战。
最近这两项新研究表明在脂质体上装备热激活触发元件能够部分解决上述问题。研究人员在实验室内对小鼠模型体内的肿瘤进行轻微加热,通过这种方式拉开了"手榴弹"的拉环,实现了对癌细胞杀伤药物的释放并达到靶向癌细胞的目的。
Kostas Kostarelos教授指出,他们将热触发温度设为42摄氏度,比正常体温高几度。虽然这项工作目前只在实验室内得到验证,但研究人员表示目前已经有一些可以根据不同的肿瘤类型对病人体内的癌细胞进行加热的方式,并且其中一些方法已经得到了临床应用。
癌症研究新方向!科学家尝试用组合式靶向疗法剿灭癌症 科技世界网
【6】切断癌细胞备用能源 “饿”死癌细胞
癌细胞的代谢过程与正常细胞有很大不同。细胞的快速增殖意味着癌细胞对能量的需求会显著增加,而葡萄糖是癌细胞的主要营养来源,它们对葡萄糖的利用速率是正常细胞的几十倍甚至几百倍。但当葡萄糖变得缺乏,癌细胞就必须转而使用备用营养物质以维持细胞生长和存活。
科学家们对葡萄糖供应减少情况下非小细胞肺癌细胞的应答情况进行了研究,结果发现一些肺癌细胞会在葡萄糖缺乏情况下转变它们对"食物"的偏好,转而使用谷氨酰胺。
研究人员发现癌细胞会通过一种叫做PEPCK的酶对癌细胞代谢进行重编程。他们发现癌细胞会表达PEPCK,帮助它们将谷氨酰胺转变成能量以及各种生物合成过程所需的原料以维持细胞生长。通过这一改变,癌细胞不仅能够保持存活,还可以在饥饿情况下继续保持增殖。
这种出色的灵活性可能也是癌症如此致命的一个重要原因,但研究人员同时表示这也为找寻新的癌症治疗方法提供了希望。
【7】微型植入物成功捕获癌细胞
细胞会随着原始的肿瘤位点而移动进而侵袭其它器官,癌细胞的这一过程被称之为癌症转移,癌症转移往往是在患者晚期阶段被发现,从而导致患者死亡。
而在血液中对循环肿瘤细胞(CTCs)的早期检测或可帮助加速癌症的诊断及疗法的开发;但游动的癌细胞会以很小的数量在机体中“旅游”,而且持续时间较长在其找到新的侵袭位点之前其非常难以发现。
研究者开发了一种大约0.5厘米宽的生物可降解的圆盘,并且对每个小鼠进行植入。这种植入物会利用免疫细胞作为诱饵,同时它还包含有一种扫描仪可以检测到捕获的癌细胞的存在。
研究者指出,这种结合系统就可以实现对转移性疾病的检测,而且可以在癌症扩散之前对患者疾病进行检测,从而就可以帮助患者制定出有效的治疗策略来遏制疾病发展,延长患者生命。随后植入物就可以对捕获的转移性癌细胞进行分析,以帮助制定最优的疗法。
【8】治疗新潜力药物—让癌细胞“得瑟”而死
癌细胞的分裂繁殖速度已经超乎正常,那如果给点刺激,让癌症细胞长得再快点会出现什么情况?——答案是会“得瑟”而死。
肿瘤细胞需要获得癌基因突变,以支持它们的生长和生存。大量的研究都集中在识别致癌基因,作为癌症药物靶标。致癌基因中,类固醇受体共激活因子(SRC)家族成员尤其具有作为治疗靶标的希望,因为这些蛋白质坐落在使癌细胞快速增长、扩散、并获得耐药性的关键信号传导途径中。在之前的研究中,Lonard和另一位同事Bert O'Malley通过筛选大量的化合物,在动物模型中确定了一种SRC抑制分子,能杀死多种癌细胞,抑制肿瘤生长。这些化合物是类似于常规的抑制癌基因的药物。但是,他们有一个违反直觉的想法:如果他们能破坏关键信号通路,过度刺激SRC,会不会杀死癌细胞?毕竟癌细胞在很大程度上依赖SRC精细调节各种细胞活动,所以SRC刺激可能与SRC抑制在扰乱癌细胞信号活性的平衡一样有效。
为了验证这个想法,他们筛选成千上万的化合物,以确定一个有效的SRC激活物——被称为MCB-613。MCB-613能杀死人乳腺癌、前列腺癌、肺癌和肝癌细胞,同时保留正常细胞。当研究人员向13只乳腺癌小鼠注射MCB-613后,这个化合物几乎完全消除了肿瘤的生长,同时没有引起毒性,而对照组的14只小鼠肿瘤在7周内长到了原来的3倍以上大小。
那具体的工作机制是什么?MCB-613使内质网上的未折叠蛋白质大量堆积。因为要支持细胞迅速繁殖,癌细胞必须合成大量的蛋白质,使负责折叠蛋白的内质网承受沉重的工作量。当过度刺激SRC后,给已经达到最大工作量的ER再添额外负担,造成了大量未折叠蛋白的积累,触发细胞的应激反应,导致毒性分子活性氧的增多。
【9】纳米微球高效高剂量狙杀癌细胞
来自加尼弗尼亚大学的研究人员通过研究开发了一种新型的纳米粒子,其可以在一类特殊蛋白存在的情况下释放药物发挥作用,而特殊蛋白则可以驱动癌症发生转移,研究者开发了一种药物运输系统,其可以有效抑制癌症的发展。
研究者Cassandra Callmann说道,我们以一种小型分子为基础构建了纳米尺度的载体,其可以找到肿瘤并且释放所装载的药物;而这种药物运输系统可以利用一种名为基质金属蛋白酶(MMPs)的特殊酶类蛋白,这种特殊的酶类蛋白在多种癌症中都非常丰富,MMPs可以“撕裂”细胞膜,使得癌细胞可以逃脱而进入机体其他部位引发癌症转移。
研究者开发了一种小型的装载抗癌药物紫杉酚的微型球状结构,并且覆盖以肽类外壳,MMPs可以撕开外壳释放其中所装载的药物,外壳碎片可以形成一种漏网,其就可以包裹药物使其对肿瘤进行稳定地作用。研究者表示,这项研究对于后期开发癌症诊断以及治疗的新型策略非常重要,为了将药物包裹如微型球体结构中,研究者进行了一定的化学处理,事实证明一系列原子对于药物分子的作用效力非常必要,而这也意味着癌症药物在达到肿瘤之前,在其流经的循环系统中是处于失活状态的,这也就避免了药物副作用的发生。
【10】化疗药物包被或可增强纳米颗粒杀灭癌细胞的效力
研究者将水凝胶沉积于作用肿瘤的纳米壳上,并且以化疗药物涂层覆盖,Jennifer West教授说道,我们的思路是将破坏肿瘤的热疗法同局部药物运输相结合,这种组合拳或是最有效的癌症治疗手段,研究表明许多化疗药物都可以有效作用于发热的组织上,因此将上述两种方法结合或许存在一定的可能性。
目前光热疗法已经应用于临床试验中进行多种癌症的治疗,纳米壳可以吸收近红外线,近红外线就可以无损伤性地穿过水和组织,然而纳米壳可以快速加热足以杀灭细胞,但其仅会在光照射的地方才会发挥作用。除了精准地靶向作用机体的特殊部位外,这种疗法还会促进纳米壳在肿瘤内部积累发挥作用。
这项研究中,研究人员用特殊的化疗药物覆盖纳米壳,同时在实验室条件下将其运输至肿瘤细胞中,随后疗法就会按照计划开始发挥作用,即纳米壳开始加热,在释放药物的同时破坏大多数的癌细胞;当然完全清除所有的癌变细胞非常重要,因为任何单一癌细胞的逃脱都有可能引发致死性的癌转移。
下一步研究者将利用活体动物来进行新型疗法的试验,当然研究者有信心在不久的将来进行人类临床试验。
-
焦点事件

-
项目成果
-
项目成果