2017第七期CPQC:关注质量控制,解读飞行检查
分析测试百科网讯 2017年3月18日,由中国社科院食品药品产业发展与监管研究中心与北京中培科检信息技术中心联合主办的2017第七期全国制药行业质量控制技术论坛(CPQC)在苏州召开。本次论坛针对国内制药行业中药品生产企业飞行检查、仿制药质量与疗效的一致性评价及药品生产中的质量控制等热门话题进行了深入的研究和探讨,为期两天的会议共进行了近20场报告,吸引了来自全国制药行业领域的专家学者、研究人员及企业代表共700余人出席,会议现场有二十余家国内外仪器厂商参加展览展示活动。分析测试百科网作为本届会议的独家支持媒体全程跟踪报道。
签到处
会议现场
中国社科院食品药品产业发展与监管研究中心主任、国家食品药品监督管理总局专家顾问 张永健
中国社科院食品药品产业发展与监管研究中心主任、国家食品药品监督管理总局专家顾问张永健为本次会议致欢迎辞。
国家资深GMP检查员、蚌埠市食品药品监督管理局安检处处长 周鹏程
国家资深GMP检查员、蚌埠市食品药品监督管理局安检处处长周鹏程为参会人员带来了题为《药品生产企业飞行检查》的报告。
报告首先介绍了药品生产检查类别简介,分为许可检查、日常检查及有因检查。针对不同的药品生产企业,日常检查的方式可以系统检查或简化检查;检查方法可以是预先通知检查和不预先通知检查(飞行检查)。
报告接下来指出,《药品医疗器械飞行检查办法》(以下简称办法)共5章35条,包括总则、启动、检查、处理及附则。《办法》将药品和医疗器械研制、生产、经营和使用全过程纳入飞行检查的范围、突出飞行检查的依法、独立、客观、公正,以问题为导向,以风险管控为核心,按照“启得快,办得实、查得严、处得准”的要求,详细规定了启动、检查、处理等相关工作程序,严格各方责任和义务,提升飞行检查的科学性、有效性和权威性。
报告总结了《办法》具有以下特点:
(1)规范了飞行检查的启动和实施,充分体现了依法独立原则。
(2)建立风险研判和分层处理措施,解决风险有效管控的问题。
(3)强调全方位多层次的衔接配合,建立顺畅的协调机制。
(4)丰富和细化应对手段,提升飞行检查的可操作性和权威性。
(5)落实监管部门职责,强化执法监督。
报告还指出了飞检中发现的主要问题,包括供应链问题、处方工艺问题、数据可靠性问题、验证问题、证照合法性问题、质量控制方面问题和质量管理。此外还有人员、厂房设备管理、生产管理、质量保证等。
周鹏程在报告最后指出了企业面对飞检所面临的工作:切合企业实际建立健全质量管理体系并能得到有效运行;质量管理体系建设的重心就在于高层,落到实处在于管理者的重视;企业要把GMP认证看作是保证药品质量的最基本要求;坚持诚实守信,禁止任何虚假、欺骗行为;飞检将是常态化,药品GMP的实施更要常态化。
上海市食品药品安全研究中心副研究员 王广平
上海市食品药品安全研究中心副研究员王广平为参会人员带来了题为《基于供给侧改革目标的仿制药一致性再评价优化路径》的报告。
报告分为供给侧改革与产能过剩、一致性评价与药品短缺、评价复杂性与制度改革和一致性评价的优化路径。
报告指出一致性评价主要针对2012版《国家基本药物目录》中口服固体制剂化学仿制药,所涉及的化学药物制剂企业仅占11%,评价工程对产业发展的整体形势影响不大。
王广平在报告介绍,复杂性突出问题是医药产业供给侧结构性的产能过剩与需求侧基本药物的药品短缺现象之间的矛盾问题,是医经济社会系统和技术系统相互作用的结果。
报告还指出一致性评价衍生出两大问题:产业安全和控费失控。王广平最后总结了一致性再评价的优化路径:一致性评价与工艺技术改造集中统一;企业自行“共保体”解决评价资金不足问题、数据完整性、政府支持、鼓励“走出去”竞争。
以下为部分参展厂商:
碧迪医疗器械(上海)有限公司
珀金埃尔默企业管理(上海)有限公司
东南科仪
福禄克测试仪器(上海)有限公司
美墨尔特(上海)贸易有限公司
普兰德(上海)贸易有限公司
苏州瀚隆医药科技有限公司
苏州长留净化科技有限公司
北京兰贝石恒温技术有限公司
德国高能泰克有限公司
上海一恒科学仪器有限公司
台湾启新生物科技有限公司
腾式中国
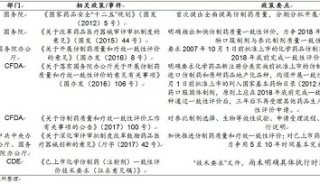
-
焦点事件

-
焦点事件