Nature:端粒酶结构解析工作最新研究进展
端粒酶(Telomerase)主要负责合成能够保护染色体末端完整性的DNA片段。最近发现的端粒酶复合体的组装机制有望帮助我们更好地认识其结构以及相关的功能。
早期有关DNA复制机制的研究发现了一个惊人的现象,即细胞在每一轮分裂的时候都会让染色体DNA的末端缩短一点点,如果放任不管,那么终究有一天,细胞里的DNA就会所剩无几了。不过不用担心,端粒酶可以解决这个问题。端粒酶是位于染色体末端的一种结构,它里面含有一系列的非编码DNA重复序列(non-coding DNA repeat),这些序列会随着每一次复制而缩短,不过它们的牺牲是有价值的,可以保护染色体内部的编码区不受细胞复制和分裂的影响。端粒酶在分裂迅速的细胞里主要起到了合成,并且维持端粒(telomeres)在一定长度的作用。后来又发现,端粒酶对于永生化的肿瘤细胞意义重大,因为它可以阻止肿瘤细胞的端粒因为细胞的快速复制分裂而缩短,这让科研人员们异常兴奋,他们认为终于找到了一种广谱的抗癌作用靶标,于是就掀起了一股研究端粒酶复合体化学结构的热潮。不过尽管经过了20多年的研究,还是有很多端粒酶的细节问题没有弄清楚,Jiang等人在《自然》(Nature)上发表的文章总算是解决了这个问题。
端粒酶一直都是蛋白质结构研究领域里的一个大难题,这是因为在细胞中端粒酶的丰度非常低,而且端粒酶本身的结构也非常复杂。端粒酶是一种全酶(holo-enzyme),由多个蛋白质亚基和一个在进化上相对保守的端粒酶RNA组成,端粒酶在细胞内的丰度很低,但是在细胞外又很难通过人工表达的方式获得。所以结构生物学家一直都将研究的重点放在端粒酶中容易获得的某些片段上,希望能够窥一斑而知全貌。
很多前期的端粒酶结构研究工作采用的都是四膜虫(Tetrahymena thermophila)这种模式生物作为研究材料。最近,对四膜虫这种原生动物体内的天然端粒酶复合体开展的生物化学研究终于取得了突破,找到了构成端粒酶全酶的所有组成分子,填补了以往研究工作中的空白。有了这些分子,以及前人积累下的高分辨率的部分结构信息,Jiang等人通过电镜(electron microscopy, EM)向我们展示了四膜虫端粒酶的完整结构,也让我们第一次看到了端粒酶的全貌。
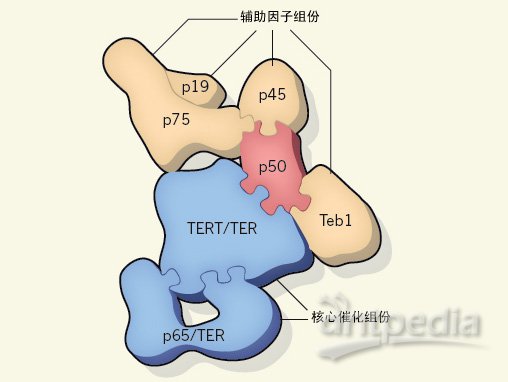
图1 端粒酶全酶简明结构图。Jiang等人通过电镜发现端粒酶全酶主要由两大部分组成,它们分别是核心催化组份和另外一端的辅助因子组份。其中p50蛋白则起到了连接这两大组份的桥梁作用。
Jiang等人使用电镜重建技术(EM reconstruction technique)首次解析出来的端粒酶全酶三维结构图的分辨率达到了25埃米(ångström)。为了确定每一个组份在全酶中的精确位置,Jiang等人又采用精细的遗传试验技术和蛋白纯化技术进行了更深入的研究。他们使用了各种能够与端粒酶全酶中的某一些部位特异性结合的抗体作为实验材料进行了试验研究,这些抗体与端粒酶结合之后也能够在电镜下成像(与没有抗体结合的图像相比,在有抗体结合的部位图像密度会更高一些)。他们还自己设计了一段RNA序列,以此来确定端粒酶本身携带的RNA片段在全酶中处于什么位置。这段人工RNA序列能够与病毒的衣壳蛋白(coat protein)结合,也能够起到类似于抗体的标记作用,在电镜成像过程中显示出来。在组成端粒酶全酶的7大蛋白组份中,除了一个蛋白之外,这些试验工作足以确定另外6大蛋白组份,以及端粒酶RNA在端粒酶中各自所处的位置。
之前的生物化学研究表明,端粒酶至少从功能上可以分为两大部分,即具有延伸端粒DNA片段功能的核心催化组份和能够促进端粒DNA片段多次延伸的辅助组份。Jiang等人获得的端粒酶三维结构图也证实了这种观点,从图1中我们可以看出,端粒酶全酶主要由两部分组成,其中一个部分就是由端粒酶RNA TER、p65和TERT等组份组成的核心催化组份,另外一个部分就是由p75、p19、p45和Teb1组成的辅助组份。Jiang等人提出了一个完整的催化核心结构模型,而且该模型也符合现有的亚基间相互作用试验数据,这也从另外一个方面验证了他们的试验结果。
这个三维结构模型还给我们带来了另外一个惊喜,我们发现在之前还没有确定功能的p50组份蛋白在端粒酶全酶中实际上起到了“中间人”的作用,p50蛋白可以将催化组份和辅助组份连接起来,而且体外实验还发现,p50蛋白对于端粒酶的活性也具有至关重要的决定性作用。这个意外的惊喜也肯定会让p50蛋白成为未来端粒酶研究工作中的热点。一定会有很多人热衷于在其它的生物系统,比如脊椎动物和酵母中寻找类似于p50的蛋白,并且证实这些蛋白是否也和p50蛋白一样具有促进多亚基复合物形成的作用。
Jiang等人得到的这份端粒酶全酶结构图给我们献上了一份出乎预料之外的大礼,也为未来的端粒酶全酶结构—功能研究工作打下了坚实的基础。比如我们可以根据这份结构图判断应该研究端粒酶全酶中哪些RNA和蛋白质,以及蛋白质之间的相互作用位点。不过我们现在还不清楚四膜虫端粒酶中的DNA处置因子(DNA-handling factors,即辅助组份)和核心端粒酶因子(core telomerase factors,即核心催化组份)之间的这种结构关系是不是也同样适用于哺乳动物的端粒酶。最近得到的一份人类端粒酶全酶电镜解析图谱表明我们人类的端粒酶和四膜虫的端粒酶还是有所区别的,我们人类的端粒酶可以形成一个有功能的二聚体。不过这份人体端粒酶的结构图谱并没有告诉我们任何有关人体端粒酶与已知的端粒酶相关DNA结合蛋白(telomerase-associated DNA-binding proteins)之间有什么相互作用。
如果要对端粒酶全酶的组装过程以及功能进行一番彻底的了解,那么就一定需要有一份高分辨率的三维结构图谱,从原子层面上去认识端粒酶组份蛋白、RNA以及DNA底物分子各自的作用。由于端粒酶的活性与肿瘤密切相关,所以对端粒酶的结构研究也有助于我们找到有价值的作用位点,针对端粒酶开发出高效的抗癌药物。Jiang等人使用的这种电镜重建技术是我们结构生物学研究领域中里程碑式的一项技术,它有助于我们解析其它多种重要蛋白的X线晶体结构(X-ray crystal structure),比如对核糖体及RNA聚合酶的结构分析等。所以我们相信,在不久的将来一定可以得到一份更清晰的端粒酶全酶三维结构图。