第十届药典委员会机构设置及职责
第十届药典委员会机构设置及主要职责(草案)
为实现国家药品标准发展规划纲要所提出的工作目标和药品监管工作的需要,为高质量完成国家药品标准工作提供组织和人员保障,以“广纳人才、合理设置、按需定岗”为原则,特制定第十届药典委员会的机构设置和主要职责,具体内容如下:
一、第十届药典委员会的机构设置
第十届药典委员会下设执行委员会和专业委员会,由主任委员、副主任委员、执行委员和委员组成。
(一)执行委员会
执行委员会应由熟悉国家有关药品法律法规、从事药品监督管理工作的管理者和医药领域资深权威专家组成,同时兼顾与药品相关的政策研究与管理、药品产业发展、科研规划、价格体系、医疗保障等部门的专家。负责审定国家药品标准发展及药典委员会发展等方面的重大方针政策;协调与药品标准工作及药典委员会发展等相关方面的重大关系。
(二)专业委员会
第十届药典委员会拟设专业委员会23个,委员317名。其中,取消政策与发展委员会、标准信息工作委员会和注射剂工作委员会;将化学药品第一、第二专业委员会调整重组为化学药品第一、第二、第三专业委员会;标准物质专业委员会增设专职委员;根据工作需要,增加相关专业委员会委员职数。
有关委员根据自身专业情况及工作需要,可以在相关专业委员会因兼任,兼任委员原则上不限名额。
二、各专业委员会的主要职责
1. 理化分析专业委员会(19人)
审订《中国药典》理化分析方法的制定和修订原则; 审订《中国药典》理化分析方法的应用原则、仪器应用和限度要求; 研究理化分析方法的发展趋势,指导相关科研工作的开展,审议科研项目成果,推荐采用成熟的科研成果; 研究解决本专业在药品标准中的其他问题。
2. 制剂专业委员会(17人)
审订《中国药典》附录制剂通则的制定和修订原则; 审订《中国药典》制剂的收载范围、分类与定义,制定共性要求及必要的检测项目; 研究制剂相关领域的发展趋势,指导相关科研工作的开展,审议科研项目成果,推荐采用成熟的科研成果; 研究解决本专业在药品标准中的其他问题。
3. 名称与术语专业委员会(7人)
审订中国药品通用名称命名原则; 负责中国药品通用名称的命名; 负责将世界卫生组织(WHO)的国际非ZL名称(INN)制定为中国药品通用名称,并及时通报WHO; 负责《中国药典》有关医药学术语的统一规范。
4. 生物检定专业委员会(9人)
审订药品生物安全性检查项目的制订原则、限度标准及应用范围; 审订有关生物安全性检查方法及指导原则; 审订药品生物测定方法和生物检定的统计方法; 研究生物检定相关领域的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决本专业在药品标准中的其他问题。
5. 微生物专业委员会(9人)
审订药品的原料、辅料及制剂的微生物限度标准、应用原则及范围; 审订有关微生物污染、防腐剂效力和除菌工艺相关的检查方法及指导原则; 研究微生物相关领域的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决本专业在药品标准中的其他问题。
6. 药用辅料与药包材专业委员会(7人)
审订《中国药典》药用辅料与药包材的标准制定和修订原则; 审订《中国药典》药用辅料与药包材的品种收载原则、范围、质控项目及方法; 研究药用辅料与药包材相关领域的发展趋势,指导相关科研工作的开展,审议科研项目成果,推荐采用成熟的科研成果; 研究解决本专业在药品标准中的其他问题。
7. 标准物质专业委员会(7人)
研究制订标准物质的相关技术指南和审评原则; 负责国家药品标准物质的审评; 研究解决标准物质在药品标准中存在的问题; 研究标准物质的发展趋势。
8.民族医药专业委员会(下设藏、蒙、维药工作组,共15 人)
研究制订民族药标准有关的技术规范和指导原则; 审订《中国药典》民族药的品种收载原则、范围、质控项目及方法; 审定民族药标准,并研究解决标准中“功能主治”表述的科学规范; 研究民族医药发展,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决民族药标准中的其他问题。
9. 中医专业委员会(31人)
审订《中国药典》中药的遴选原则和收载范围; 审订和规范《中国药典》一部品种医学部分(功能主治、用法用量、注意); 审订《临床用药须知》中药制剂卷和中药饮片卷; 审查和规范中药药品标准的医学部分和药品说明书; 研究中医标准与临床应用的关联性,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决本专业在药品标准中的其他问题。
10. 中药材与饮片专业委员会(27人)
审订中药材与饮片相关的技术规范和指导原则; 审订《中国药典》中药材与饮片的品种收载原则、范围、质控项目及方法; 审定中药材与饮片的质量标准; 研究中药材与饮片的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决中药材与饮片质量标准中的其他问题。
11. 中成药专业委员会(27人)
审订中成药相关的技术规范和指导原则; 审订《中国药典》中成药的品种收载原则、范围、质控项目及方法; 审定中成药的质量标准; 研究中成药的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决中成药质量标准中的其他问题。
12. 天然药物专业委员会(7人)
审订天然药物、油脂与提取物等相关的技术规范和指导原则; 审订《中国药典》天然药物、油脂与提取物的品种收载原则、范围、质控项目及方法; 审定天然药物、油脂与提取物的质量标准; 研究相关领域的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决天然药物、油脂与提取物质量标准中的其他问题。
13. 医学专业委员会(31 人)
审订《中国药典》化学药和生物制品的遴选原则和收载范围; 审订《临床用药须知》化学药和生物制品卷; 审查和规范化学药和生物制品的说明书; 负责收载品种的临床调研、收集和反馈临床用药信息; 根据药品临床使用的情况,对标准制定、修订中的有关内容提出具体意见和建议。
14. 化学药品第一专业委员会(13人)
审订相关类别化学药的技术规范和指导原则; 审订《中国药典》化学药相关类别的品种收载原则、范围、质控项目及方法; 审定心血管药、皮肤用药、抗肿瘤和免疫抑制药、抗病毒药、血液系统用药、利尿药和脱水药、中枢兴奋药、抗震颤麻痹药和部分化学合成抗感染药等类别的药品标准; 研究相关类别化学药品的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决相关类别化学药品标准中的其他问题。
15. 化学药品第二专业委员会(13 人)
审订相关类别化学药的技术规范和指导原则; 审订《中国药典》化学药相关类别的品种收载原则、范围、质控项目及方法; 审定激素及内分泌药、抗组胺药、子宫收缩药及引产药、维生素类、微量元素与营养药和X线照影剂和诊断用药、呼吸系统用药、解毒药、消毒防腐药和部分化学合成抗感染药等类别的药品标准; 研究相关类别化学药品的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决相关类别化学药品标准中的其他问题。
16. 化学药品第三专业委员会(13 人)
审订相关类别化学药的技术规范和指导原则; 审订《中国药典》化学药相关类别的品种收载原则、范围、质控项目及方法; 审定麻醉药与麻醉辅助用药、安眠镇静药、抗癫痫药、解热镇痛药、镇痛药、消化系统药、抗寄生虫药、糖类、盐类与酸碱平衡药等类别的药品标准; 研究相关类别化学药品的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决相关类别化学药品标准中的其他问题。
17. 抗生素专业委员会(11人)
审订抗生素药品的技术规范和指导原则; 审订《中国药典》抗生素的品种收载原则、范围、质控项目及方法; 审定抗生素的药品标准; 研究抗生素的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究抗生素药品标准中的其他问题。
18. 生化药专业委员会(7 人)
审订生化药的技术规范和指导原则; 审订《中国药典》生化药的品种收载原则、范围、质控项目及方法; 审定生化药的药品标准; 研究生化药的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究生化药品标准中的其他问题。
19. 放射性药品专业委员会(7人)
审订放射性药品的技术规范和指导原则; 审订《中国药典》放射性药品的品种收载原则、范围、质控项目及方法; 审定放射性药品的药品标准; 研究放射性药品的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究放射性药品标准中的其他问题。
20.生物技术专业委员会(11人)
审订生物技术制品标准的制定和修订原则; 审订《中国药典》生物技术制品的品种收载原则、范围、质控项目及方法; 审定生物技术制品的药品标准; 研究生物技术的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决本专业在药品标准中的其他问题。
21. 病毒制品专业委员会(9人)
审订病毒类制品标准的制定和修订原则; 审订《中国药典》病毒类制品的品种收载的原则、范围、质控项目及方法; 审定病毒类制品药品标准; 研究病毒类制品的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决病毒类制品标准中的其他问题。
22.细菌制品专业委员会(9人)
审订细菌类制品标准的制定和修订原则; 审订《中国药典》细菌类制品的品种收载原则、范围、质控项目及方法; 审定细菌类制品药品标准; 研究细菌类制品的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决细菌类制品标准中的其他问题。
23.血液制品专业委员会(下设血源筛查用体外诊断试剂工作组,共9人)
审订血液制品(体外诊断生物试剂)标准的制定和修订原则; 审订《中国药典》血液制品(体外诊断生物试剂)的品种收载原则、范围、质控项目及方法; 审定血液制品(体外诊断生物试剂)药品标准; 研究血液制品(体外诊断生物试剂)的发展趋势,指导相关科研工作的开展,审议科研项目成果,并推荐采用成熟的科研成果; 研究解决血液制品(体外诊断生物试剂)标准中的其他问题。
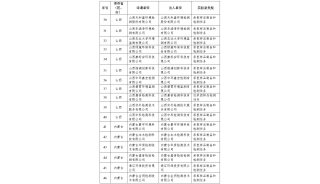
相关阅读:第十届药典委员会各专业委员会委员职数设置
-
焦点事件

-
会议会展

-
标准

-
焦点事件

-
焦点事件

-
政策法规
-
焦点事件

-
政策法规
-
标准

-
焦点事件

-
焦点事件

-
标准

-
焦点事件

-
焦点事件

-
标准

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
-
标准

-
焦点事件

-
政策法规

-
焦点事件

-
政策法规
-
焦点事件

-
政策法规

-
焦点事件

-
政策法规

-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
标准
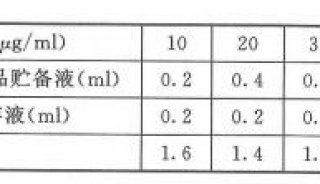
-
标准
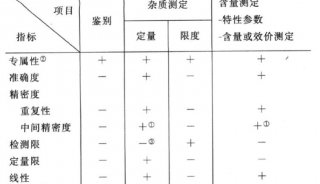
-
标准
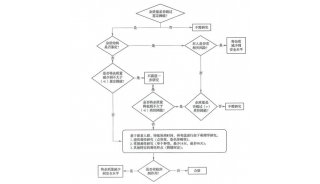
-
会议会展

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
综述
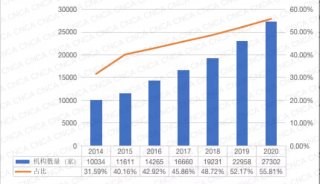
-
焦点事件

-
焦点事件
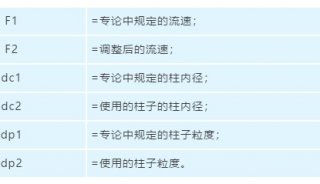
-
财报

-
焦点事件

-
实验室动态

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
标准

-
焦点事件
-
焦点事件

-
标准

-
标准

-
标准

-
标准

-
焦点事件

-
焦点事件

-
焦点事件

-
标准

-
会议会展

-
会议会展
-
会议会展

-
焦点事件

-
焦点事件

-
标准
-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
政策法规

-
政策法规

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
政策法规

-
科技前沿

-
政策法规

-
政策法规

-
焦点事件

-
焦点事件