SCIEX专访:如何应对药物临床史上最严“稽查风暴”
分析测试百科网讯 2015年7月22日,国家食品药品监督管理总局发布了《国家食品药品监督管理总局关于开展药物临床试验数据自查核查工作的公告(2015年第117号)》,(下称“公告”),公告要求,即日起,所有已申报并在总局待审的药品注册申请人,均须按照《药物临床试验质量管理规范》等相关要求,对照临床试验方案,对已申报生产或进口的待审药品注册申请药物临床试验情况开展自查,确保临床试验数据真实、可靠,相关证据保存完整。
此公告一出,便引起了药品产业的广泛关注,被称为中国药业“史上最严的数据核查公告”。CFDA用了四个“最”来做要求,“最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责”,有人称之为“七二二惨案”,有人说这是2006年注册风暴的再次上演。
如何应对此次“稽查风暴”?作为有着30多年质谱经验的SCIEX,针对这次事件,有怎样的解决方案?分析测试百科的记者带着疑问采访了SCIEX公司中国区药物市场发展高级经理程薇和药物行业市场经理张克荣。
SCIEX公司中国区药物市场发展高级经理程薇(右)和药物行业市场经理张克荣(左)
史上最严的数据核查公告
此次“公告”核查的内容包括了生物样本分析测试仪器(如HPLC、LC-MS/MS)等主要的试验仪器设备运行和维护、数据管理软件稽查模块(Audit trail)的安装及其运行等。
药品审评过程中,发现申请人有下列情形之一的,将依据《药品注册管理办法》第一百五十四条的有关规定,注册申请不予批准。包括:(一)拒绝、逃避或者阻碍检查或者毁灭证据的;(二)临床试验数据不能溯源,数据不完整的;(三)真实性存疑而无合理解释和证据的;(四)未提交自查报告的。
对核查中发现临床试验数据真实性存在问题的相关申请人,3年内不受理其申请。药物临床试验机构存在弄虚作假的,吊销药物临床试验机构的资格;对临床试验中存在违规行为的人员通报相关部门依法查处。将弄虚作假的申请人、临床试验机构、合同研究组织以及相关责任人员等列入黑名单。
“在药物研发的过程中,前期的基础研究、疾病发现和药物发现是没有法规监管的,但是到后期药物研发、临床试验和药物生产等,都需要遵守相关法律规定。后期就是从GLP(药品非临床研究质量管理规范)到GMP(药品生产管理规范),再到GCP(药物临床试验质量管理规范)的过程。”张克荣说。
随着国家法规越来越严格,药物生产企业需要更重视数据的真实性、可靠性、合理性,所以在采集数据和写报告的过程中,仪器硬件和软件都能符合法规的要求,对于后期数据的可靠性以及给我们造成的损失也会越来越小。
由二十多年FDA经验的专家设计
SCIEX针对这次审核带来的解决方案是它们的一款经典软件“SCIEX Analyst”,Analyst软件是SCIEX质谱的操作软件,Analyst软件满足行业法规要求即FDA 21 CFR PART 11的电子签名和电子记录要求,界面简单易用。其中的审计追踪功能(Audit Trail)是不可分割的一部分(自带功能)。
Audit Trail中文就是审计追踪,相对于这次的公告来说,就是对于数据分析做的任何动作都需要追查,比如修改数据、修改时间、添加或者是删除以及自动积分变成手动的积分都自动记录。
“我们的软件,是由在FDA工作了二十多年的专家参与设计的,他们的审核理念在我们的软件当中完美地呈现了。”程薇说,“报批美国FDA必须符合FDA的要求,他们不看图谱库,只看数据是否真实、合理、可靠,看你是否在数据方面弄虚作假,这就需要看你的操作是否符合逻辑,是否前后矛盾等,所以这就需要一个软件专门记录操作者所有的操作步骤。”
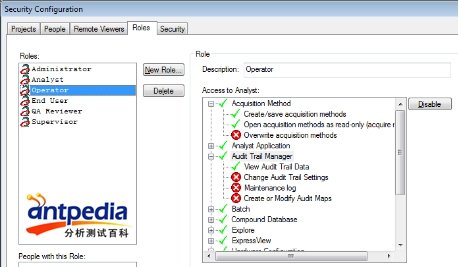
不同的人员可设置不同的权限
因为任务分配各不相同,实验室有实验操作人员、方法开发人员和数据审核人员等角色,SCIEX Analyst软件可以让不同角色设置和分配不同的权限,这样可以避免数据人人可见,也方便QA的数据审核。
访问权限设置
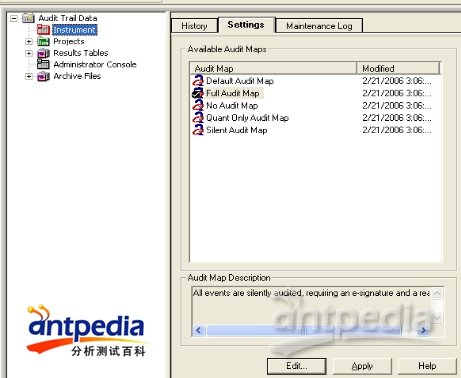
Audit Trail:可实现四个方面的审计追踪
审计追踪是SCIEX Analyst中的一项功能,Audit Trail包含四个审计项目:
1、仪器(instrument):仪器的开启、访问、shutdown、维护等都有记录;
2、项目(project):每个项目,开始时间,方法的建立,提交的样品信息,在项目下都有记录;
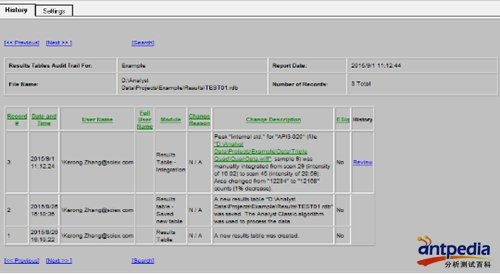
3、数据结果列表(Results Tables):实验数据的定量结果,数据积分的方法,样品的情况,在结果列表中都清晰可见;
4、存档文件(Archive Files):记录消息每到达1000条,就会进行自动存档。
SCIEX Analyst软件的Audit Trail功能是默认开启的,以上的项目都可涉及,若是要求比较严的实验室,需要有电子签名,用户可以根据需求进行自定义。
Audit Trail 审计追踪模块:默认自动开启
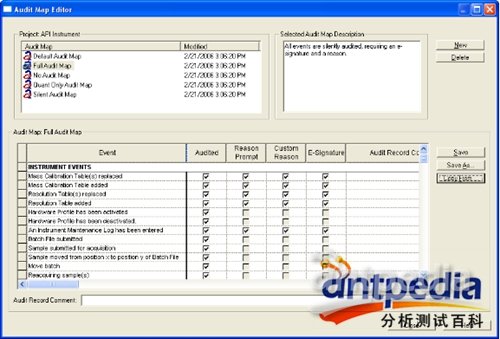
Audit Trail设置、编辑:客户可根据需求自定义
性能稳定 可无限制记录
“我们几年前的仪器,包括三重四极杆、Qtrap、高分辨质谱等都安装了Analyst软件,非常稳定,这些年客户反馈一直都很好。因为我们一开始设计的起点就非常高,把所有审计能想到的都想了。”程薇说,“我们有一个医院的老客户,十年来一直都用着同一台仪器,用着同一个软件,记录非常完整。”
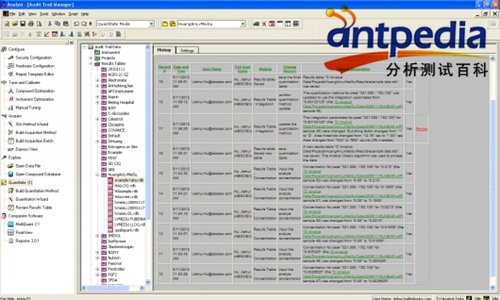
Audit Trail结果浏览
Audit Trail结果浏览:简单、直观
更好地满足药物临床实验需求
“SCIEX在质谱行业已经有33年历史,液质有二十多年的历史,在二十几年中,最早进入的是医药工业,辉瑞、GSH等都是我们的老客户了,都有我们上百台仪器。”程薇说,“因为他们的产品最终都要通过FDA的审核,FDA的法规肯定会影响仪器软件的设计,而我们的软件都是跟着这些大药厂一起做的,通过客户的反馈,我们再根据客户的需求进行软件研发和商品化。”
美国药事法规是目前世界上最系统、最完整、最科学的药事法规之一。美国最主要的药品管理部门FDA以严格、科学的管理著称,成为世界各国药政机构效仿的对象。GMP(good manufacture practice)和GRP(good review practice)等概念均源自于美国。美国认为FDA药品管理的历史就是美国药事法规发展的历史。
在中国,尤其是近年来,药品生产管理日趋严格。《药品生产质量管理规范》在1988年第一次颁布了中国的药品GMP。“监管部门的要求会日趋严格,国人的法规意识也会越来越强。我们的SCIEX Analyst能够帮助制药企业更好地达到《国家食品药品监督管理总局关于开展药物临床试验数据自查核查工作的公告》的要求。”程薇说。
关于Audit Trail的网络视频讲座请点击:您准备好应对"质谱数据审计追踪(Audit Trail)"的策略了吗?
-
企业风采

-
企业风采

-
企业风采

-
产品技术

-
产品技术

-
产品技术

-
企业风采

-
并购

-
产品技术