上海巴斯德所合作研究发现调节性T细胞功能调控新机制
6月10日,国际学术期刊《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America, PNAS)在线发表了中国科学院上海巴斯德研究所李斌课题组和美国宾州州立大学郑颂国课题组合作的最新研究成果Inflammation negatively regulates FOXP3 and regulatory T cells function via DBC1(《在炎症环境下乳腺癌缺失分子1调控FOXP3蛋白和调节性T细胞功能》)。该项研究发现了转录因子FOXP3蛋白的新的结合蛋白DBC1,从而揭示了炎症条件下调控调节性T细胞功能的新机制。
调节性T细胞能够抑制过度的免疫反应,对于抑制自身免疫性疾病,维持整个机体的免疫稳态以及在感染状态下调控免疫反应起着非常重要的作用。调节性T细胞功能失调,会导致严重的自身免疫病以及炎性疾病,包括I型糖尿病、风湿性关节炎、多能硬化症以及系统性红斑狼疮等。FOXP3是调节性T细胞的重要的转录因子,FOXP3蛋白的表达以及其稳定性直接调控调节性T细胞的功能。当前的研究显示,FOXP3是通过与不同的蛋白结合形成复合体,从而精准且有序地调控调节性T细胞的功能。然而,至今对FOXP3复合体的研究以及FOXP3复合体在不同生理和病理状态下的调控机制仍然不清楚。
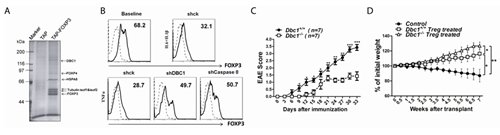
上海巴斯德所分子免疫学课题组博士研究生高雅懿、上海东方医院免疫和移植研究中心硕博连读生唐嘉佑等在研究员李斌和郑颂国的指导下,通过串联亲和层析和质谱的方法,发现了FOXP3复合物新的组成成分——乳腺癌缺失分子1(Deleted in Breast Cancer 1, DBC1)。研究人员发现DBC1能够和FOXP3蛋白直接相互作用,并能在炎症条件下促进FOXP3蛋白的降解。在自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis, EAE)和关节炎模型中,Dbc1敲除小鼠与野生型小鼠比较,敲除小鼠的发病滞后且病症更轻,FOXP3蛋白更稳定,Treg的抑制活性更强。另外,研究人员还发现,胱天蛋白酶8(Caspase 8)介导炎症条件下DBC1对FOXP3功能的调控。抑制胱天蛋白酶8的活性或者下调胱天蛋白酶8的表达,能够逆转炎症条件下FOXP3蛋白的降解。该项研究成果揭示了在炎症条件下FOXP3复合物的新的调控机制,为今后自身免疫病的治疗提供了新的思路和靶标。
该项研究获得国家自然科学基金委员会重点及面上项目、科技部“973”项目、上海市科委基础重点项目、中科院百人计划等经费支持。
图A、串联亲和层析纯化FOXP3复合物。图B、在炎症因子TNFα存在条件下,缺失DBC1或Caspase8的人源Treg细胞中的FOXP3蛋白更稳定。图C、在EAE模型中,与野生型小鼠比较,Dbc1敲除小鼠的发病滞后且病症更轻。图D、在肠炎模型中,用缺失Dbc1的Treg细胞或者野生型的Treg细胞与效应细胞共同移植至Rag2-/-小鼠体内,前者的肠炎症状最轻。