生物物理所解析线虫精氨酸对称双甲基化酶的晶体结构
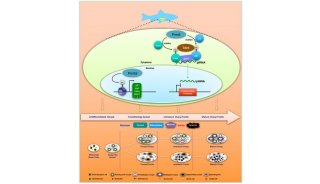
线虫PRMT5晶体结构示意图,其活性单位为同源二聚体
12月5日,美国《国家科学院院刊》(PNAS) 在线发表了中科院生物物理研究所许瑞明、龚为民、刘迎芳研究组以及遗传发育所鲍时来课题组合作的最新研究成果Structural Insights into Protein Arginine Symmetric Dimethylation by PRMT5。
组蛋白甲基化是表观遗传学的核心内容之一,主要包括赖氨酸和精氨酸的甲基化修饰。相对于赖氨酸的单甲基、双甲基和三甲基化修饰,精氨酸也存在单甲基及双甲基化修饰。精氨酸双甲基化修饰中,对称性及非对称性修饰有着不同的生物学意义及识别机制。如针对组蛋白H4R3位点的双甲基化修饰中,对称修饰抑制基因表达,非对称修饰则与基因激活密切相关。但关于这两类修饰的反应机理,特别是对称性与非对称性修饰酶催化机制的差别还知之甚少。
这项新的研究工作解析了线虫精氨酸对称双甲基化酶PRMT5的晶体结构。根据已知的结构信息设计突变体实验,确定了PRMT5精氨酸甲基转移酶活性、特别是对称性双甲基化活性的关键残基,分析了PRMT5作为对称性双甲基化酶与其他非对称性双甲基化酶的结构差别。
这些结果对于理解精氨酸双甲基化修饰的作用机理及调控细节,具有重要意义。
该研究工作得到科技部、国家自然科学基金委员会和中国科学院的资助。
推荐
-
科技前沿

-
项目成果