查看完整版本请点击这里:
【求助】SDS-PAGE蛋白条带模糊?
【求助】SDS-PAGE蛋白条带模糊?
最近跑蛋白胶条带总是很模糊,以为是染色液用久了,就新配了染色液,但是情况依旧没有改观。
弱弱的问一下,大家配的SDS-PAGE缓冲液一般用多久啊?溶液放久了对实验结果有这么大的影响吗?
感觉条带很不清晰,但是又不知道什么原因。请大家帮忙分析一下。
查看完整版本请点击这里:
【求助】SDS-PAGE蛋白条带模糊?
【求助】SDS-PAGE蛋白条带模糊?
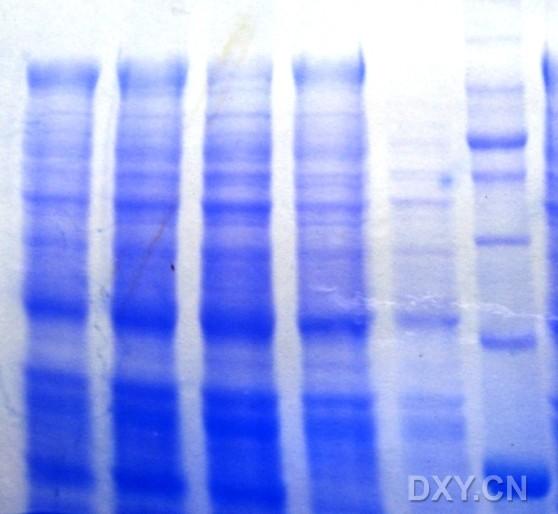
22581578.snap.jpg
字体: 小 中 大 | 打印 发表于: 2014-2-03 22:43 作者: JK.jon 来源: 分析测试百科网

22581578.snap.jpg
最新回复
ALALA (2014-2-03 22:43:21)
是不是上样量有点大啊。
ALALA (2014-2-03 22:43:52)
JK.jon (2014-2-03 22:44:08)
分离胶7.5%,浓缩胶5%
我看了好多图,感觉都不是很清楚
我是1ml菌体培养物离心,弃上清,加120ul水和30ul的5x上样BUFFER,沸水煮15分钟。取20-30ul上样。
standup (2014-2-03 22:44:28)
yychen (2014-2-03 22:44:45)
standup (2014-2-03 22:45:10)
电泳缓冲液是新配的,如果是5乘上样缓冲液的问题,那又是为什么呢
vvmmoy (2014-2-03 22:45:38)
1)更不是电泳液的问题,电泳液只会导致电流大小,影响跑胶的速度。即便电泳液很脏,但是那些脏东西能跑进胶里吗?即便跑进去了,能想蛋白一样被染色吗? 好好分析下。 以后再别因为胶不干净来找电泳液的原因
2)貌似胶的浓度是小了点。(不知道楼主所说的模糊,是指包括Marker在内的条带也模糊还是说,样品带上太模糊了)如果样品带太模糊,建议再稍微减少样品用量,煮沸后离心2-3min,吸取样品上清点样。
3)我更坚持的一个观点是,你这个胶照相出问题了,似乎没有对准焦距。如果自己用相继照的,可以再稳当点,锁定好焦距。如果是仪器照相,建议,用一小纸片(带字的)放在你胶的一角,调节焦距,如果能很清晰的看到纸片上的字,再稍微拉大一点点焦距即可(或者把胶的厚度忽略不计,就不用继续拉大)。
有时候,实验结果很容易出,但必须要仔细处理结果才可以!
个人意见。
红茶可乐 (2014-2-03 22:46:11)
电泳缓冲液是新配的,如果是5乘上样缓冲液的问题,那又是为什么呢
========================================
所有条带特别浅 是你的染色液用此次数到期了
gogo (2014-2-03 22:46:31)
我也遇到过类似情况,经过试剂重配,条带较为清晰。采取的措施有:
1:在配制分离胶和浓缩胶时,用灭菌蒸馏水,不要用非灭菌蒸馏水。
2:重新配制TRIS-HCL(PH8.8和6.8),PH值一定要精确。
3:1%SDS和1%过硫酸铵,要现配现用,要用灭菌蒸馏水稀释。
4:电泳缓冲液,要现配现用。
祝成功!
join (2014-2-03 22:46:57)
我感觉好像也是照相时候没有对准焦距。
baidukk (2014-2-03 22:47:19)
我以前也遇到这种情况,我认为可能有以下四种情况:
1. 染色液放置时间太长,因此更换染色液(这个原因排除,你说你用新配的染色液)。
2. 电泳缓冲液用的次数太多了,一般电泳液最多用两次;此外,电泳缓冲母液应放置4度冰箱保存。
3. 配置电泳缓冲液的水应为蒸馏水,若不用蒸馏水会出现条带模糊现象。
4. 可能也与你提的蛋白质量不好也有关系(如提蛋白的试剂配的不对),蛋白质量不好也会出现条带模糊现象。
panda王 (2014-2-03 22:47:53)
2)貌似胶的浓度是小了点。(不知道楼主所说的模糊,是指包括Marker在内的条带也模糊还是说,样品带上太模糊了)如果样品带太模糊,建议再稍微减少样品用量,煮沸后离心2-3min,吸取样品上清点样。
3)我更坚持的一个观点是,你这个胶照相出问题了,似乎没有对准焦距。如果自己用相继照的,可以再稳当点,锁定好焦距。如果是仪器照相,建议,用一小纸片(带字的)放在你胶的一角,调节焦距,如果能很清晰的看到纸片上的字,再稍微拉大一点点焦距即可(或者把胶的厚度忽略不计,就不用继续拉大)。
有时候,实验结果很容易出,但必须要仔细处理结果才可以!
个人意见。
===============================================================================================================
结果照相出问题的可能性比较大。
第一 调焦距的时候 应选择胶上某一条条带来对照,而不是任意某一点。在你这个照片里面。我可以看到你所用纸张的褶皱,所以对焦的问题你也应该考虑在内。
第二 上样量,如果你所要检测的蛋白丰度本来就比较高的话,可以酌情减少上样量,否则,则需要提高上样量。
yychen (2014-2-03 22:48:10)
根据个人经验,是缓冲液和上样buffer的问题。每次重新开始的时候条带很清晰,慢慢就不理想了。如过缓冲液和上样buffer上下点功夫,情况就能控制了。仅供参考哦。
PPT (2014-2-03 22:48:45)
第一 调焦距的时候 应选择胶上某一条条带来对照,而不是任意某一点。在你这个照片里面。我可以看到你所用纸张的褶皱,所以对焦的问题你也应该考虑在内。
第二 上样量,如果你所要检测的蛋白丰度本来就比较高的话,可以酌情减少上样量,否则,则需要提高上样量。
个人一点看法,供参考!
===================================================================
胶是楼主自己跑的 ,他会因为只看了照片不行,就说胶不清楚吗???
要不你处理后甩一下样品试试吧,这块胶也不是特别的不清楚,只是蛋白丰度较高吧。
finger (2014-2-03 22:49:26)
我看了好多图,感觉都不是很清楚
我是1ml菌体培养物离心,弃上清,加120ul水和30ul的5x上样BUFFER,沸水煮15分钟。取20-30ul上样。
===============================================
1.上样量太多了。1ml的菌,我一般只用5ul上样。
2.煮沸5分钟。之后10000rpm离心2分钟,再取上清上样。
TAT (2014-2-03 22:49:54)
QUOTE:
同意楼上看法,可以适当的降低上样量,上样前要高速离心,还有就是上样buffer,用新配的怎么样。
huifeng0516 (2014-2-03 22:50:19)
huifeng0516 (2014-2-03 22:50:41)
可以看到你低丰度的条带也不够锐利
huifeng0516 (2014-2-03 22:51:14)
本人觉得既不是配胶缓冲液也不是上样缓冲液的问题,而是样品处理的问题。楼上有的提过样品在煮过之后高速离心,这一步是必须的。看这张图片最后一道是Marker吗,还是比较清晰的。
star#room (2014-2-03 22:51:38)
感觉你的样品量还是不算太多,不过少一点会更好,比较容易跑出锐利的条带,我都是用尽量少的量
【求助】SDS-PAGE蛋白条带模糊?