查看完整版本请点击这里:
【求助】Tricine-SDS-PAGE跑不动,而且溴芬兰变黄!
【求助】Tricine-SDS-PAGE跑不动,而且溴芬兰变黄!
各位战友,最近实验遇到了困难,7kD多肽要用电泳检测,师兄说检测小肽要用Tricine-SDS-PAGE,可是我做了一个多月了,一直都没摸索好条件,主要问题是:
1. 跑不动(电泳2h溴芬兰才刚刚进入分离胶,继续电泳4h溴芬兰才到分离胶中间的位置)
2. 溴芬兰进入分离胶后约2h开始变黄
看了以前的帖子,分析原因可能是电泳缓冲液、凝胶缓冲液和上样缓冲液的pH不对,所以全部重新配的,而且全部一次性,没有重复利用,电泳时正负极间有气泡,说明电路的是通的(不过槽比较旧,接触不良,用皮筋儿勒住上盖就没事了),制胶用的胶条也撕掉了,这个因素也排除,我经验有限,实在找不出问题在哪。
为了让大家帮我分析原因,我把我的溶液配置、实验方法和电泳图发上来
1. 30%丙烯酰胺溶液
2. 凝胶缓冲液
三羟甲基氨基甲烷(Tris) 36.3g
SDS 0.3g
溶于80ml水,盐酸调pH至8.45,定容至100ml。2~8℃保存,3个月内使用。
3. 正极缓冲液
三羟甲基氨基甲烷(Tris) 24.4g
溶于800ml水后,盐酸调pH至8.9,定容至1000ml。4℃保存。
4. 负极缓冲液
三羟甲基氨基甲烷(Tris) 12.2g
SDS 1.0g
Tricine 17.9g
溶于800ml水后,盐酸调pH至8.25(未调时测pH为8.24),定容至1000ml。4℃保存。
7. 2×样品缓冲液(10ml)
浓缩胶缓冲液 0.48ml
80%甘油 5.0ml
10% SDS 0.8ml
1%溴酚蓝 0.2ml
1M DTT 2ml
水 1.4ml
制胶:
16%分离胶:(6ml)
30%丙烯酰胺溶液 6.4ml
凝胶缓冲液 4.0ml
甘油 1.6ml
10%过硫酸铵 60ul
TEMED 6ul
4%浓缩胶:(5ml)
30%丙烯酰胺溶液 0.67ml
凝胶缓冲液 1.67ml
水 2.50ml
10%过硫酸铵 50ul
TEMED 5ul
点样:以10ul/孔
程序1:恒压40v,至进入分离胶(约2.5h)
程序2:恒压100v(跑至分离胶一半约用4h)
固定,染色,脱色(这三步应该没问题)
请大家帮帮我~这步电泳对我的实验和毕业都非常重要~~~
查看完整版本请点击这里:
【求助】Tricine-SDS-PAGE跑不动,而且溴芬兰变黄!
【求助】Tricine-SDS-PAGE跑不动,而且溴芬兰变黄!
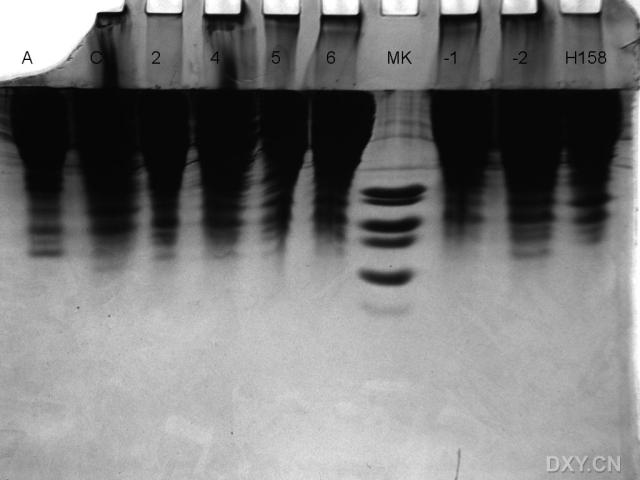
90133773.snap.jpg



最新回复
fsdd817 (2014-3-27 22:33:27)
1 上样量太多。减少到1/5-1/10试试看。
2 电泳好像没有什么问题。tricine胶是要跑得慢一些,且胶浓度也大。你电压太低,自然跑得慢。如果玻板不会裂,可以直接100V电泳。我用北京六一的电泳槽(约8×10cm),都直接150 V。
3 溴酚蓝变黄,是因为pH低的原因。只要电泳分离好,影响不大的。
tuuu2 (2014-3-27 22:33:51)
改为49.5%(Acr48.0g,Bis1.5g)
4. 负极缓冲液
三羟甲基氨基甲烷(Tris) 12.2g
SDS 1.0g
Tricine 17.9g
溶于800ml水后,盐酸调pH至8.25(未调时测pH为8.24),定容至1000ml。4℃
保存。
这个不用调pH配制后应该在8.3左右。
7. 2×样品缓冲液(10ml)
可以配成4x的
制胶:
16%分离胶:(6ml)
DDW 1.2ml
49.5%丙烯酰胺溶液 2.0ml
凝胶缓冲液 2.0ml
甘油 0.8ml
10%过硫酸铵 60ul
TEMED 6ul
点样:以10ul/孔(可以稀释2-5倍上样)
程序1:恒压40v,至进入分离胶(约2.5h)
程序2:恒压100v(跑至分离胶一半约用4h)
电压太小了,蛋白容易分散。可以直接恒流20-30V(根据自己的电泳仪选择)
固定,染色,脱色(这三步应该没问题)
嗅酚蓝变黄是缓冲偏酸了。不知是否与你调了缓冲的pH有关
yjf1026 (2014-3-27 22:34:11)
你的问题和有可能出在缓冲液上。如果PH没有调准,就会出现跑不动,发热量高的问题。
utt0989 (2014-3-27 22:34:31)
gogo (2014-3-27 22:34:49)
duoduo (2014-3-27 22:35:17)
===============================================================================================
样品都是一样处理的,之间应该没有什么差别,而且都是在进入分离胶后才开始慢慢变黄,而且总是从中间向两周扩散呢?
duoduo (2014-3-27 22:36:11)
============================================================
确实有点漏,不过漏得很慢。
我的电泳是自始至终都跑的很慢,难道漏过去几滴就会有那么大的影响吗?
redbutterfly (2014-3-27 22:37:19)
重新配吧,我也范过同样的毛病
gogo (2014-3-27 22:37:42)
这个你看看,尽量不漏啊,其他的按照protocol来应该没问题的啊.
7437654 (2014-3-27 22:38:04)
样品都是一样处理的,之间应该没有什么差别,而且都是在进入分离胶后才开始慢慢变黄,而且总是从中间向两周扩散呢?
-----------
兩邊有加BUFFER嗎?不過如果10道全部滿的話,周邊是有點影響的
看圖,和LS說的一樣,减少上樣量吧,一般MINI膠都是用30mg的上樣量
【求助】Tricine-SDS-PAGE跑不动,而且溴芬兰变黄!