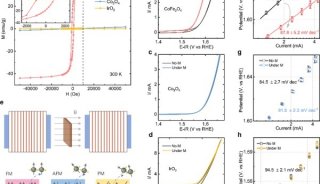
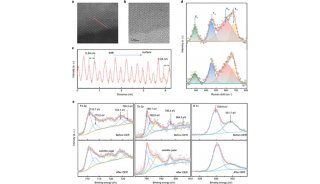
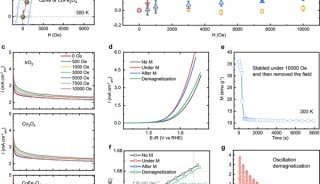
生化与细胞所发现整合素α4β7功能调控的新机制
11月22日,美国《国家科学院院刊》(PNAS)在线发表了中科院上海生命科学研究院生化与细胞所陈剑峰课题组的最新研究成果,阐明了阳离子-π相互作用对于整合素α4β7的亲和性及其相关信号转导的新调节机制。
白细胞的迁移运动是炎症反应病理过程中的重要步骤和关键环节。整合素作为一类重要的细胞表面粘附分子,是直接介导白细胞迁移运动的重要蛋白,与炎症反应关系密切。整合素α4β7主要表达在淋巴细胞表面,负责介导淋巴细胞从血液循环进入肠道和中枢神经系统,其功能的异常与人类自身免疫疾病密切相关,如溃疡性结肠炎、克罗恩病等。整合素与配体的结合及其介导的信号转导是受到严格的调控的。这种精确的动态调控机制一直以来都是整合素研究领域的热点。
前期的研究表明,整合素β亚基I结构域中的specific determining loop(SDL)与SyMBS是两个重要的整合素功能调控元件。SDL具有非常柔性的结构,与整合素识别配体的特异性有关;而SyMBS金属离子结合位点是整合素活化所必须的,但是它们的精细调控机制还不清楚。
陈剑峰课题组的潘有东博士等人发现了整合素α4β7的SDL与SyMBS通过一个特殊的阳离子-p相互作用相连接。该阳离子-p相互作用的丧失严重影响了高亲和性α4β7介导的细胞稳定粘附,但是对低亲和性α4β7介导的细胞滚动粘附影响很小。此外,α4β7介导的细胞运动也受到抑制。缺失该阳离子-π相互作用会引起α4β7胞内区的部分分离,产生一种异常的outside-in信号,引起FAK表达及其磷酸化的上调。胞内paxillin蛋白水平上调、paxillin与α4β7的结合增强,进而抑制了整合素介导的细胞铺展。
研究还发现,阳离子-π相互作用的丧失会提高paxillin的磷酸化水平并抑制talin的剪切,从而稳定了粘着斑。同时,整合素通过inside-out信号的活化过程也依赖于该阳离子-π相互作用。
该研究首次提出了阳离子-p相互作用调控整合素的功能,揭示了整合素SyMBS位点通过该阳离子-π相互作用联系SDL、协同调控α4β7的功能。该发现不仅揭示了整合素功能的一个新调控机制,还对阳离子-π相互作用在蛋白中的生理功能提供了新的证据。
该研究课题获得国家科技部973项目、国家自然科学基金委、中国科学院和上海市科委的经费资助。
-
焦点事件
-
焦点事件

-
项目成果

-
焦点事件

-
项目成果
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
会议会展

-
科技前沿
-
科技前沿
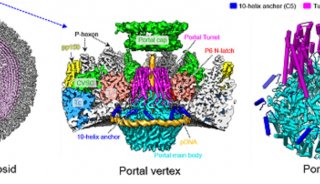
-
项目成果

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿
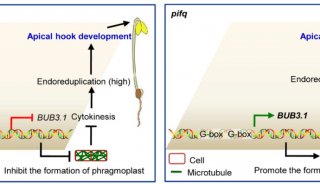
-
科技前沿

-
科技前沿
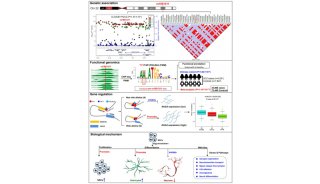
-
科技前沿

-
科技前沿
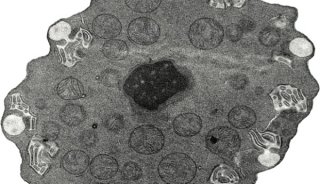
-
技术原理
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
-
项目成果

-
焦点事件
-
项目成果
-
科技前沿

-
项目成果
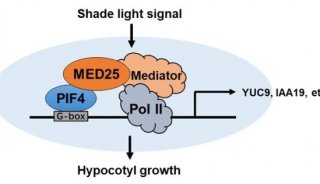
-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
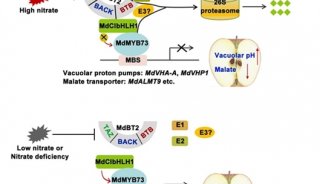
-
焦点事件
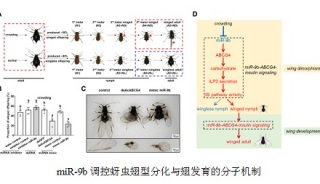
-
焦点事件

-
项目成果
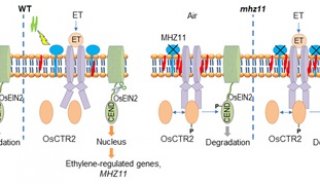
-
项目成果

-
项目成果
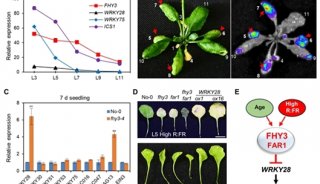
-
项目成果
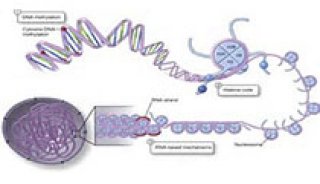
-
项目成果

-
项目成果

-
项目成果

-
项目成果
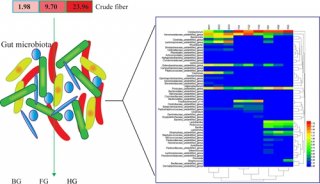
-
项目成果
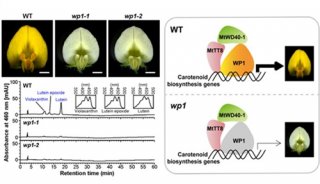
-
项目成果
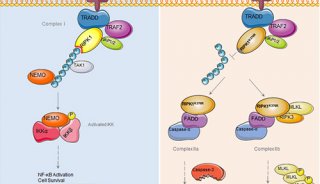
-
项目成果
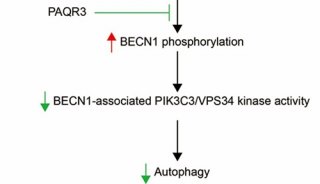
-
项目成果

-
项目成果
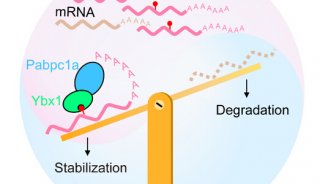
-
科技前沿
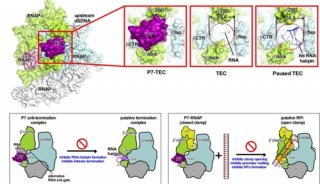
-
科技前沿

-
项目成果
-
科技前沿

-
项目成果