徐华强教授Nature发布十年研究里程碑成果
利用最明亮的X-射线激光,科学家们确定了负责调控至关重要的生理功能,可作为重要药物靶点的一个分子复合物的结构。新研究结果为科学家们提供了更具选择性的药物治疗靶向信号通路路线图,这有可能促使开发出副作用更小、更有效的疗法来治疗心脏病、神经退行性疾病和癌症等疾病。这项研究在线发布在《自然》(Nature)杂志上。
领导这一研究的是任职于中国科学院上海药物研究所和Van Andel研究所的徐华强(H. Eric Xu)博士。徐华强2009年入选国家千人计划,其研究组主要从事核激素受体、肝脏生长因子(HGF)受体、G蛋白偶联受体(GPCR)、离子通道和植物激素受体等结构与功能领域的研究,开展基于晶体结构的肿瘤与糖尿病的药物研发,获得多项原创性发现。在Nature、Science 、Science Signaling、 JBC、PNAS等国际著名学术期刊发表论文100多篇。
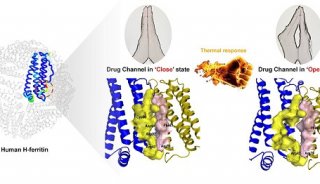
在过去的十年里,徐华强领导的研究小组一直在致力揭示在细胞通讯中起极重要作用的信号蛋白arrestin,与G蛋白偶联受体(GPCR) rhodopsin构成的复合物的结构。Arrestin与 其他称作为G蛋白的信号蛋白都可以结合GPCRs传递重要的指令,来执行例如生长和激素调控等许多基本的生理功能。G蛋白信号通路和arrestin信号 通路在生理上截然不同;可选择性调控其中一条信号通路的GPCR抑制剂往往被当做首选药物,因为它们相比非选择性的药物能够带来更好的治疗效果,且不良副 作用较小。
徐华强和他的研究小组利用美国能源部SLAC国家加速器实验室的SLAC直线加速器相干光源(Linac Coherent Light Source,LCLS是目前世界上最强的X射线自由电子激光器),生成了与GPCR结合时arrestin的首个三维图像。LCLS能够以比以往X-射 线源强10亿倍的亮度发射X-射线脉冲。这使得研究人员能够以比传统X-射线技术高得多的分辨率——在原子水平上构建出arrestin -rhodopsin复合物的三维图像。
徐华强说:“Arrestin和G蛋白是调控GPCR功能的阴阳两面。在药物开发领域,详细地了解这些类型蛋白质的结构、相互作用及功能对于开发出有效的疗法具有至关重要的意义。互作越特异,药物就能够越好地发挥作用,同时也降低了产生副作用的机会。”
GPCRs是目前已知细胞表面受体家族中最大的一个分支,其通过接收来自外源的“数据”,告知细胞有关环境的信息及传递来自邻近细胞的信息充当了细 胞的信息交流站。由于定位在细胞的表面使得药物疗法更容易触及它们,细胞表面受体成为了极好的治疗靶点。鉴于它们在细胞通讯中发挥中心作用,GPCRs是 开发新疗法的重要靶点,也是大约40%现有药物的靶点。
在此项研究之前,科学家们对于arrestin如何结合GPCRs,谁开启了一组细胞信号,及这与G蛋白和GPCR互作之间的差别,谁激活了不同组 的细胞信号均知之甚少。2011年,由来自斯坦福大学和密歇根大学的科学家领导的一个研究小组获得了一项重大的突破,揭示了第一个G蛋白结合GPCR的结 构。结合徐华强的新研究工作,这些研究发现为开发出特异性激活arrestin信号通路或G蛋白信号通路的疗法奠定了基础。
托马斯杰斐逊大学GPCR 专家Jeffrey Benovic教授(未参与该研究)说:“徐华强课题组拼合出了一个重要的故事,为我们了解G蛋白偶联受体功能提供了一些非常重要的见解。这一 rhodopsin-arrestin结构可帮助解释脱敏过程,为获得其他GPCR复合物的结构提供了一张线路图。”
徐华强和他的研究还计划利用LCLS开展其他的一些研究,包括解释参与完整GPCR型号周期的蛋白质复合物的结构,及一些小分子药物调控这一周期的机制。
-
项目成果
-
项目成果

-
项目成果
-
科技前沿

-
项目成果