上海巴斯德所在pDC抗病毒感染研究中取得进展
5月1日,国际期刊《实验医学杂志》(The Journal Experimental of Medicine)在线发表了中国科学院上海巴斯德研究所肖晖研究组的最新研究成果:Epigenetic regulator CXXC5 recruits DNA demethylase Tet2 to regulate TLR7/9-elicited IFN response in pDCs(《表观遗传分子CXXC5在pDC中通过招募DNA去甲基化酶Tet2调节TLR7/9诱导的I型干扰素表达》)。该研究首次发现在浆样树突细胞(pDC)中特异表达的表观遗传分子CXXC5通过招募DNA去甲基化酶Tet2,导致Irf7基因启动子区域的CpG岛处于低甲基化状态,从而保障了pDC中IRF7高表达及其诱导大量I型干扰素,有效清除病毒感染的能力。这一研究首次发现了表观遗传调节机制,特别是DNA甲基化修饰,在调节pDC功能方面的关键作用,验证了表观遗传学机制在免疫细胞发育、分化和功能维持方面的重要作用,也为治疗病菌感染和自身免疫性疾病提供了新思路。
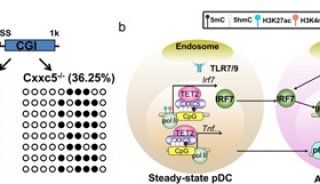
在病毒感染早期,pDC能够快速产生大量的I型干扰素,因此在控制病毒感染和调节天然免疫、适应性免疫反应中起重要作用。目前为止,虽然对于pDC通过TLR7/9信号激活转录因子IRF7,诱导I型干扰素表达的信号转导路径已经比较清楚,然而对于在众多的免疫细胞中为什么只有pDC特异地高表达IRF7,其中的分子机制并不清楚。
上海巴斯德所和苏州大学联合培养博士研究生马世鑫在研究员肖晖和教授高晓明的指导下,通过筛选发现ZF-CXXC家族的表观遗传分子CXXC5特异地高表达于pDC中,并参与调节TLR7/9和病毒诱导的I型干扰素表达。在机制方面,发现CXXC5通过其CXXC结构域与Irf7基因启动子区域的CpG岛结合,然后招募DNA去甲基化酶Tet2,以降低该区域的5’-胞嘧啶甲基化水平(5’-mC);通过重塑该区域的染色体修饰和构型,导致IRF7组成型表达。在RNA、DNA病毒感染时,CXXC5基因敲除的小鼠不能快速产生大量的I型干扰素,因此丧失了抵抗病毒感染的能力,表明CXXC5介导的表观遗传学调控机制在宿主防御中起着重要作用。
该项研究得到国家自然科学基金委重点项目、科技部重点研发计划和“973”计划、中科院战略性先导科技专项B类等项目的支持。
-
焦点事件
-
焦点事件
-
会议会展

-
焦点事件
-
项目成果