施一公院士Cell Res解析关键蛋白结构
来自清华大学生科院的研究人员发表了题为“Crystal structure and biochemical analysis of the heptameric Lsm1-7 complex”的短讯文章,揭示了Lsm1-7复合物的结构新机制,相关成果公布在Cell Research杂志上。
文章的通讯作者是早年毕业于清华大学的施一公教授,施一公教授自回国之后就引起了各方关注,虽然经历了不少舆论争议,但他在学术上依然走出了自己的一条道路,回国后这5年里,施一公在Nature等国际顶级期刊上发表了多篇论文,同时他也搭建起了以清华大学为中心的人才引入桥梁。去年当选为中科院院士。
真核生物执行翻译功能的信使RNA(messenger RNA)在细胞核内的成熟需要经历一个非常复杂的剪切和拼接过程,这个过程主要是由五个小核核糖核蛋白(small nuclear ribonucleoproteins, snRNP)和一系列的辅助蛋白构成的巨大分子机器——剪切体(spliceosome)执行的。每种snRNP都由一条小核RNA(small nuclear RNA)和与之特异性结合的七元环蛋白质复合物组成。大部分的七元环复合物是Sm 蛋白质七聚体,只有在U6小核核糖核蛋白中为Lsm蛋白质七聚体复合物。
Lsm蛋白家族有十多个成员,在各个物种中高度保守,参与各种与RNA代谢相关的信号通路。在真核细胞中,组成U6 小核核糖核蛋白的蛋白质复合物是Lsm2/3/4/5/6/7/8。它能够特异地识别U6 RNA的3’末端序列,并帮助U6 RNA与剪切体其他成员相互作用,催化RNA的剪接过程。
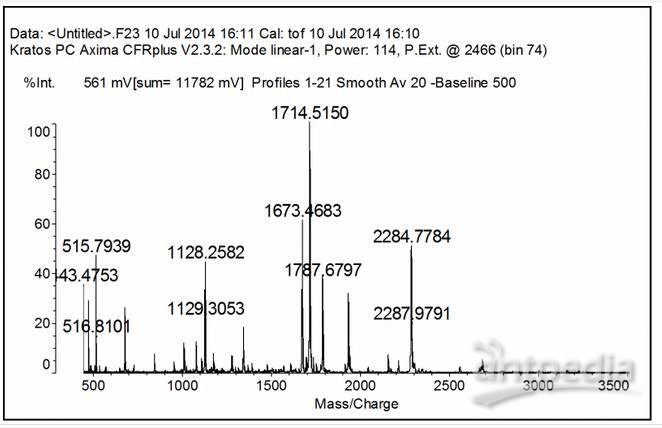
此前施一公研究组曾发表论文阐述Lsm蛋白质复合物特异性识别剪切体U6 RNA的分子机制,在这一基础上,研究人员又成功地利用pQLink plasmid共表达了酿酒酵母中所有的七个Lsm蛋白,并将这一Lsm1-7复合物进行了纯化,通过质谱确认了所有七个蛋白。
然而之后研究人员虽然进行了严格的实验,但依然无法结晶Lsm1-7复合物。为了解决这个问题,他们进行了一种系统性蛋白工程试验,尝试去除可变序列,以及将半胱氨酸突变为丝氨酸,从而最终对这种复合物进行了结晶,获得了分辨率为3.0的结构模型。
通过结构分析,研究人员发现Lsm1-7复合物结构通过一个Sm样同源七聚体连接,由硒基单反常色散(single anomalous dispersion,SAD,生物通译),和分子置换结合而成。
酿酒酵母的Lsm1-7复合物的外形有些像是一个厚的甜甜圈,外径约70 Å,内径为5 Å,且厚度为45 Å。七个Lsm部件依次相连形成一个封闭的环,顺序为Lsm1-Lsm2-Lsm3-Lsm6-Lsm5-Lsm7-Lsm4。
这项研究进一步深入探讨了Lsm复合物的结构机制,为此领域的相关研究提供了新的设计思路和研究方法。