2013第三届中国仿制药峰会在沪召开
2013年3月28日,由CPhl Conferences主办的第三届中国仿制药峰会在上海世纪皇冠假日酒店举行。本届盛会邀请了120位来自政府机构、仿制药企业、原研药企业的决策者共聚于此,深入探讨仿制药从药的出发、应用、注册到生产的核心环节中遇到的困惑和难度,从仿制药的审评制度更新、工艺质量创新以及“引进来和走出去”药研合作从三大板块进行深入探讨,为国内外从事仿制药领域的专业人士提供交流与展示的平台,促进仿制药产业链的升级发展与交流合作。
第三届中国仿制药峰会现场
首先是UBM主办方负责会议策划的王之怡女士致欢迎词:“UBM会议团队致力于通过本次峰会为您提供与同行交流经验、再续或重建合作关系、表达行业观点的机会。我们相信,在仿制药行业,仿制药中国峰会2013必将有助于您进一步规划2013年的技术和战略发展。仿制药产业‘十二五’发展规划明确提出将全面提高仿制药质量的规划下,中国仿制药市场从‘抢仿’到‘创新’,优胜劣汰的市场标准必将主导国内巨大的仿制药市场。近几年,国外上市新药不断减少,世界原料药产业慢慢向发展中国家转移,今后几年将是国际药品ZL到期的高峰时期,中国等发展中国家将成为仿制药产业发展重点转移目的地,面对这种形势,仿制药成未来我国制药产业踏板,企业完全可以‘仿中有制’,在‘国际竞争国内化,国内竞争国际化’的中国仿制药市场上、在工艺创新上大有作为。”
UBM主办方 王之怡女士
本届中国仿制药盛会得到了安捷伦科技、沃特世公司、南京药石、华禧联合科技、方达医药技术、德泊亭工程设计的赞助支持。
上海食品药品检验所 谢沐风老师
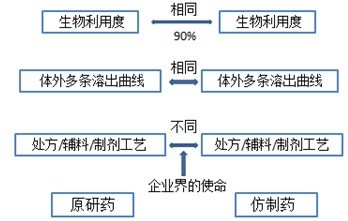
来自上海食品药品检验所的谢沐风老师介绍了《仿制药“一致性评价的标准”最新解读与应对要点》。主要阐述了溶出度和生物利用度的相关性、并探讨了仿制药研发的瓶颈以及现今仿制药研发的思路,呼吁业内对体外溶出度的重视。
目前国内用药现状
1、某些固体制剂国产药与进口原研药相比、临床疗效相距甚远、价格也相差悬殊;2、为什么不同厂家生产的同一制剂、甚至同一厂家生产的不同批号,病人服用后也会有不同疗效;3、大量低水平的仿制药存在,恶性、低价竞争!国产制剂(包括固体制剂)出路何在?4、液体制剂的滥用。
溶出度
国内已上市仿制药中安全、无效的不在少数,尤其是难溶性速释制剂和缓控释制剂,因此疗效才是硬道理,即生物利用度。
溶出度/释放度是指:在多pH值溶出介质中溶出曲线的测定,绝非一个介质、一个时间点、一个限度的测定!该测定已成为“剖析”和“肢解”原研固体制剂内在品质一种擘肌分理、抽丝剥茧的重要手段;成为固体制剂内在品质呈现于外在的一种“表象”、“映射”与“载体”。因此只有溶出度/释放度才是“固体制剂内在品质的灵魂与核心所在”!而溶出度的核心理念则是多条溶出曲线的测定,它也是口服固体制剂的“指纹图谱”。多条溶出曲线可用于评价不同来源同一制剂内在品质差距,从而为彼此间临床疗效差距提供佐证,国家评价性抽验就采用了该理念。还可用于固体制剂药物研发与质量评价、生物等效性试验的前期预测、各类变更的评价及与口服固体制剂内在品质相关的所有环节。
仿制药研发的“瓶颈”
从专业角度看:疗效的优劣即药物在体内吸收的多寡,是与生物利用度紧密相关的。优质药品可在任何体内环境下(即pH值得宽范围内)都有一定的崩解、溶出,即对任何的人群均有较高的生物利用度。而劣质药品可能只在一种体内环境下(如胃酸正常者)才有一定的溶出和吸收,而在其他体内环境下可能崩解、溶出就会很差,生物利用度也就很低。因此溶出度与生物利用度也有着很大的相关性。
仿制药研发的必由之路:“殊途同归”。
仿制药研发的“瓶颈”即工艺放大,可具体到:1、首先测定原研品的都条溶出曲线;2、仿制药研发进程:小试→中试→放大。以上每一步骤样品的多条曲线均应与原研品一致,直至放大生产到一定规模、连续三批,即宣告“仿制成功”!
现今仿制药研发思路
秉承国家药审中心提出的“仿产品而不是仿标准”,现今研发仿制药正确思路如下:1、查询既有质量标准:各国药典、国家药监局标准、进口质量标准以及其他资料[日本橙皮书、美国溶出曲线数据库以及美国临床用药手册(PDR)、国内已发表文献]。2、取1~3批原研品,用多条溶出曲线循序渐进般“剖析与肢解”后(再辅以有关物质的厘清),如既有质量标准与研究论证结果相符(即溶出度试验各参数),证明既有标准科学客观,可参照。如发现既有标准制订得不合理、无法正确反映该药品应具有的内在优良品质,此时不能画地为牢、以讹传讹、应更改;3、自身纺织品的开发,从小试、中试、放大直至具备一定生产规模。每一阶段样品的多条释放曲线皆应与原研品一致。
而后谢老师还阐明了自己的观点,只有提高技术要求和门槛方能从根源上解决问题,并在最后送上了自己对企业的寄语。