清华大学PNAS发表蛋白转运新成果
ABC(ATP结合盒)转运蛋白是一个古老而庞大的蛋白家族,包括一百多种膜转运蛋白。这种转运蛋白广泛存在于细菌、植物和哺乳动物的各种细胞中,主要功能是利用水解ATP的能量来驱动物质跨膜运输。ABC转运蛋白参与了多种物质的转运,底物可以是离子、单糖、氨基酸、磷脂、肽、多糖和蛋白质。大部分ABC蛋白由两个跨膜结构域和两个核苷酸结合结构域组成。
根据物质转运的方向,ABC转运蛋白可以分为内向转运蛋白(importer)和外向转运蛋白(exporter)。日前,清华大学和柏林洪堡大学的研究团队获得了一个氨基酸ABC转运蛋白的晶体结构,揭示了它与底物特异性结合的结构基础。这项研究发表在四月六日的美国国家科学院院刊PNAS杂志上,文章的通讯作者是清华大学生科院的杨茂君(Maojun Yang)教授和柏林洪堡大学的Erwin Schneider。
之前有研究表明,ABC外向转运蛋白和内向转运蛋白通过共同的机制起作用,涉及面向内(inward-facing)和面向外(outward-facing)状态之间的转换。不过,人们并不清楚ABC转运蛋白的具体作用机制,尤其是其底物识别机制。
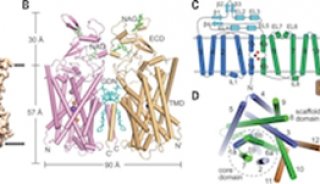
研究人员从腾冲嗜热厌氧菌(Thermoanaerobacter tengcongensis)中获得了一个氨基酸ABC内向转运蛋白Art(QN)2,分析了该转运蛋白结合不同底物时的分子结构。这项研究为人们展示了跨膜结构域ArtQ和核苷酸结合结构域ArtN的组织形式,以及一个跨膜的底物转运通道。
值得注意的是,Art(QN)2每个跨膜结构域都有一个带负电的口袋,形成了负电的内部通道,允许带正电的氨基酸通过。研究人员在脂蛋白体中对Art(QN)2进行功能分析,发现它会根据底物进行构象变化,刺激ATPase的活性。
这项研究阐明了ABC转运蛋白的一种底物结合模式,可以帮助人们更好的理解ABC转运蛋白选择和转运底物的具体机制。
杨茂君博士,教授,博导
1995-1999 吉林大学,学士;1999-2003 中国协和医科大学,博士;2003-2004 德国吕贝克大学,高级访问学者;2004-2008美国西南医学中心,博士后;2008-至今 清华大学生命科学学院,教授、博导
主要科研领域与方向:本实验室主要围绕与传染病、癌症等人类重大疾病发生息息相关的可溶性蛋白及膜蛋白进行结构与功能研究,以及针对这些蛋白质的高分辨晶体结构为基础的小分子化合物筛选及设计。近年来主要在细胞感应外界信号以及物质跨膜转运,蛋白质泛素化调控两个方面得到了部分研究成果。