生化与细胞所等揭示一种新的蛋白质部分降解机制
国际学术期刊Developmental Cell于6月6日在线发表了中科院上海生科院生物化学与细胞生物学研究所赵允研究组、张雷研究组关于Ter94复合物选择K11连接形式泛素化修饰的Ci蛋白被蛋白酶体部分降解的最新研究成果。该工作与加拿大多伦多大学Chi-chung Hui教授合作完成。
蛋白质的泛素化降解作为一个重要的调控机制参与了细胞内的多种生命活动。在这个过程中,蛋白质本身会被加上一种叫做泛素(ubiquitin)的小分子修饰,形成泛素链,从而作为标签被蛋白酶体(proteasome)识别降解。
除了蛋白质的完全降解,人们发现有部分蛋白会通过泛素化-蛋白酶体系统发生部分降解,生成一种具有生物学功能的截短形式的蛋白质片段。其中最典型的例子是Ci/Gli家族的一类蛋白质,它们作为一种直接结合DNA的转录因子发挥作用,调节了与癌症密切相关的Hedgehog信号转导通路的活性。全长的Ci/Gli蛋白能激活Hedgehog通路,而截短的Ci/Gli蛋白则发挥相反的抑制功能。近年来,人们对于Ci/Gli蛋白的部分降解进行了大量的研究,但对于蛋白酶体选择实现部分降解的分子机制仍不清楚。
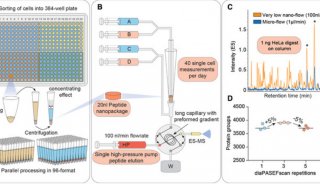
博士研究生张召在赵允、张雷研究员的指导下,利用果蝇这种模式生物对Ci/Gli蛋白的部分降解机制进行了系统的研究。研究发现,虽然已有报道Ci蛋白会被Cul1-Slimb和Cul3-Hib两种不同的E3泛素连接酶(E3 ligase)识别,但形成的泛素链是不同的。Cul1-Slimb能在Ci蛋白上特异地形成一种K11连接形式的泛素链,这与传统的K48连接形式泛素链介导的降解是不同的。进一步的研究发现,Ter94/p97蛋白复合物作为一种ATP水解酶(ATPase)也特异性参与了Ci蛋白的部分降解。Ter94/p97蛋白复合物能识别K11连接形式的泛素链,将K11泛素化的Ci选择投递至蛋白酶体,发生部分降解。
该发现首次揭示了Ter94/p97和K11连接形式的泛素链在蛋白质部分降解过程中发挥了重要的作用,也为Gli异常激活所导致的癌症治疗提供了潜在的药物靶点。
该项研究工作得到了国家科技部、国家自然科学基金委以及中国科学院的支持。
-
招标采购

-
项目成果
-
企业风采

-
焦点事件