浙大,清华发表Nature Structural & Molecular Biology文章
生物通报道:来自浙江大学生命科学研究院,清华大学的研究人员报道了两个前所未有的GspD通道冷冻电镜结构,为理解胰泌素超家族,以及II类分泌系统底物运输的机制提供了一个结构基础。这一研究成果公布在1月9日的Nature Structural & Molecular Biology杂志上。
在革兰氏阴性细菌中已发现四种蛋白质分泌途径,称为I、II、III、IV型分泌机制,其中II类分泌系统的胰泌素(Secretin)又称促胰液素,是第一种被发现的激素,即由十二指肠粘膜S细胞和分散在空肠(主要是上端)的S细胞释放的消化道激素,这种激素主要作用是刺激胰脏外分泌腺分泌水和碳酸氢钠,刺激胆汁分泌,抑制胃泌素释放和胃酸分泌,以及抑制胃肠蠕动,并延缓胃液和固体食物的排空。
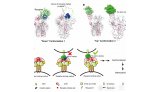
胰泌素GspD能在革兰氏阴性细菌中形成穿过外膜的通道,将底物从细胞周质运输到细胞外环境去。然而目前这种GspD通道的原子分辨率结构尚不清楚,这阻碍了II类分泌系统的进一步研究。为此在这篇文章中,研究人员报道了两个GspD通道(〜1 MDa)的冷冻电镜结构,分辨率约为3Å,这两个GspD通道分别来自大肠杆菌K12和霍乱弧菌。
通过分析这些结构,研究人员发现了一个十五聚体通道结构,构成了GspD N结构域的三个环状结构,形成周质通道。胰泌素结构域组成了一种新的双β-桶通道结构,每个“桶”中至少有60个β-链,并通过S结构域维持稳定。外膜通道则由富含β链的门控密封,由此研究人员在捕获的开放结构基础上提出了一个详细的开门机制。
总体来说,这一结构为理解胰泌素超家族,以及II类分泌系统底物运输的机制提供了一个结构基础。
-
焦点事件