中科院,清华大学发表最新Nature文章
来自哥伦比亚大学,中国科学院和云南省动物模型与人类疾病机理重点实验室,清华大学生科院的研究人员发表了题为“Structure of a eukaryotic cyclic-nucleotide-gated channel”的文章,报道了真核生物环核苷酸门控离子通道(CNG离子通道)的最新单粒子电子冷冻显微结构,这将为理解环核苷酸门控通道的离子渗透,门控和通道病变以及相关通道的环核苷酸调控奠定了基础。
这一研究成果公布在1月18日的Nature杂志上,文章的通讯作者是哥伦比亚大学,动物模型与人类疾病机理重点实验室的杨建研究员,以及清华大学生科院李雪明研究员。
环核苷酸门控离子通道(cyclic nucleotide-gated ion channels,CNG)最早是由Fesenko等人于1985年在Nature杂志上报道,此后科学家们陆续报道了多种相似的通道,他们发现CNG离子通道不仅存在于光感受器和OSNs等神经元组织中,在其它非神经元组织中也有表达,由此迅速成为生命科学中的一个热点领域。
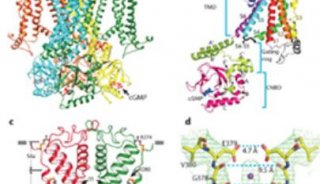
CNG通道是动物组织和细胞中很重要的离子通道之一,也是视觉和嗅觉的必要条件,这一类通道属于电压门控离子通道超家族,但它们的活性由胞内环核苷酸而不是跨膜电压控制。在最新这项研究中,研究人员报道了来自秀丽隐杆线虫的一个分辨率为环核苷酸门控离子通道单粒子电子冷冻显微镜结构,这一环核苷酸门控离子通道处于环磷酸鸟苷(cGMP)开放状态。
通过分析这一结构,研究人员发现这一通道具有独特的类似电压传感器的结构域,这解释了它为何不依赖于电压门控。羧基末端连接S6与环核苷酸结合结构域直接与电压传感器样结构域,以及孔结构域相互作用,形成能耦合由环核苷酸绑定门控引发的构象变化的门控环。这种选择性过滤设备则是通过具有重要功能的谷氨酸和三个主链羰基环结构排列成羧酸酯侧链。
研究人员指出,这种结构为理解环核苷酸门控通道的离子渗透,门控和通道病变以及相关通道的环核苷酸调控提供了新的框架。
清华大学在通道结构解析方面取得了许多成果,如早期颜宁教授曾报告了来自海洋α-变形菌(Alphaproteobacterium)HIMB114的NaChBac同源物NavRh高达3.05埃的高分辨率的晶体结构。通过对三维晶体结构的分析,研究人员发现该通道包含了一个不对称的四聚体。还有尹长城等人获得的钙离子激活RyR1开放态结构,他们通过比对关闭和开放状态下的区别,揭示了钙离子如何通过长程变构“激活”RyR1的机制。
文章通讯作者李雪明研究员近期也在Nature Structural & Molecular Biology杂志上发文,揭示了细菌II型分泌系统外膜复合物GspD分泌素通道的原子分辨率结构以及通道的半开放状态结构。
-
项目成果