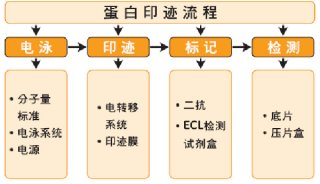
蛋白质的Western blot印迹分析
一、原理
一个基因表达的最终产物是产生相应的蛋白,因此检测蛋白是测定基因表达的主要标志。
原理:Western Blotting 是将获得的蛋白质样品通过SDS-聚丙稀酰胺凝胶电泳,对不同分子量的蛋白质进行分离;并通过转移电泳将凝胶上分离到的蛋白质转印至固相支持物上,用抗靶蛋白的非标记抗体(一抗)与转印后膜进行杂交,使其与膜上的靶蛋白特异性结合;再与经过氧化物酶标记的二抗结合,最后用ECL试剂反应,经X线片曝光、显影等一系列反应,检测蛋白质等生物大分子。
二、方法
样品蛋白的制备
SDS-聚丙稀酰胺凝胶电泳 转膜 检测
三、样品蛋白的制备
1、原理:
蛋白质的制备工作涉及物理、化学和生物等各方面知识,但基本原理只有两个方面:
一是用混合物中几个组分分配率的差别,把它们分配到可用机械方法分离的两个或几个物相中,如盐析、有机溶剂提取、 层析和结晶等;
二是将混合物置于单一物相中,通过物理力场的作用使备组分分配于不同区域而达到分离目的,如电泳、超速离心、超滤等。
2、蛋白质制备的步骤
(1) 选择材料和预处理
(2)细胞的破碎及细胞的分离
(3)提取和纯化
(4)浓缩、干燥和保存
3、培养细胞中蛋白质样品的提取
提取细胞蛋白多是利用将细胞裂解、破碎、使蛋白质释放 的原理,在提取蛋白质的实验中要考虑到细胞裂解液的pH、去 污剂的类型和浓度,以及二价阳离子、辅助因子等因素,同时 为防止细胞内蛋白酶对蛋白质的降解,需在裂解液中加入蛋白 酶抑制剂。
3.1 实验材料
(1)器材: 冷冻离心机, 细胞刮,Tip头、1.5ml、 0.5ml 灭菌Ep管,碎冰。
(2)试剂:
① 细胞总蛋白裂解液(100ml): 1×PBS 80ml,Triton100 1ml, 去氧胆酸钠0.5g, SDS 0.1g, 补 1×PBS缓冲液至 100ml。 ② PMSF贮存液(PMSF 17.4mg/异丙醇): PMSF(苯 甲基磺酰氟)在水溶液中不稳定,应在临用前向不含PMSF的裂 解缓冲液中加入PMSF贮存液100ul,使其终浓度为0.174mg/ml。 (3)Hela 细胞
3.2 实验方法
(1) 洗涤细胞:选取细胞培养皿中培养的Hela细胞,由37℃ 取出后放入冰盘中,预冷。吸弃原培养液,用4 ℃预冷的 1×PBS洗细胞表面3~4次,除净培养基中的血清,并尽量吸弃 细胞培养皿中残余的PBS。
(2) 向培养皿中加入蛋白裂解液(100ul/60mm),轻轻晃动, 使裂解液均匀铺于细胞表面。
(3) 冰浴30~60min,期间晃动3~4次。
(4) 用细胞刮子集中裂解液,收集入冰上预冷的1.5ml Ep 管 中, 4 ℃离心,12000g 20min.
(5) 小心吸取上清液入新的预冷管中(为避免反复冻融导致 蛋白降解,可按需要将其分装使用),-80 ℃保有存备用(可 保存1年)
3.3 注意事项
(1) 注意个人防护:PMSF严重损害呼吸道黏膜、眼睛及皮 肤,吸入、吞进或通过皮肤吸收有致命危险。一旦眼晴或皮 肤接触了PMSF,立即用大量清水冲洗。
(2) 设立必要实验对照。
(3) 为防止蛋白降解,上述操作全部应在冰上完成。
(4) 所用离心机需要提前预冷。
(5)可于显微镜下观察细胸裂解的程度。
(6)吸取蛋白上清液时,注意不要把沉淀吸上来。
4、蛋白质的浓度测定——考马斯亮蓝蛋白定量法
考马斯亮蓝 G-250 法是比色法与色素法相结合的复合方 法,简便快捷,灵敏度高,稳定性好,是一种较好的常用方 法。 4.1 原理
考马斯亮蓝 G-250 在游离状态下呈红色,最大光吸收在 488nm;当它与蛋白质结合后变为青色, 蛋白质-色素结合物 在 595nm 波长下有最大光吸收。 其光吸收值与蛋白质含量 成正比, 因此可用于蛋白质的定量测定。 蛋白质与考马斯亮 蓝 G-250 结合在 2min 左右的时间内达到平衡,完成反应十 分迅速;其结合物在室温下 1h 内保持稳定。
4.2 实验材料
(1)器材:分光光度计及玻璃比色皿
(2)试剂:
①0.5% mg/ml BSA 标准蛋白液:生理盐水配制,分装小管, 4℃保存。
②考马斯亮蓝 G-250 母液:称取考马斯亮蓝 G-250 100mg 溶 于 50 ml 95%乙醇,加入 100 ml 浓磷酸(W/V)。过滤, 4℃ 保存6个月。
③考马斯亮蓝 G-250 使用液(0.01%考马斯亮蓝 G-250 ): 取考马斯亮蓝G-250 母液 15 ml,加蒸馏水稀释至 85 ml,临 用前稀释。
4.3 实验方法
(1) 稀释BSA标准品及制作标准曲线:用生理盐水将 0.5mg/ml 牛血清白蛋白(BSA)标准蛋白液稀释成 0,1,2,4,8,10,12 ug/100ul
(2)上述每管中分别加入 1.5ml 考马斯亮蓝 G-250 使用液, 室温反应后测定 595 nm吸光度值(OD595),依据所得数据制作 标准曲线。
(3)稀释待测蛋白样品:吸取细胞总蛋白样品 2 ul,加入 98 ul 水(总体积为 100 ul )和 1.5 ml 考马斯亮蓝使用液,混匀 后室温反应3~5 min,测定OD595 。
(4)计算样品总蛋白含量(ug/ul):根据标准曲线图,找出样品蛋白在图中的位置,并计算出蛋白含量。
4.4 注意事项
(1)制作的BSA标准曲线如不规律,应重新再做。
(2)如果待测样品浓度高(如组织提取物),可用生理盐水 稀释倍后测定;如样品浓度底,可适当增加样品体积及减少水 的体积。
(3)比色皿的清洁:由于测定液中含有考马斯亮蓝,使用过 的比色皿呈蓝色并蓝色不易被清水冲洗掉,需用无水乙醇先将 比色皿脱色皿脱色数分钟,而后分别用自来水、蒸馏水冲洗干净。
四、SDS-聚丙烯酰胺凝胶电脉
1、原理
各种蛋白质因所带的净电荷、分子量大小和形状不同面有不同 的迁移率。如果在电泳体系加入SDS,形成带负电荷长椭圆棒状 的蛋白质-SDS复合物。从而消除蛋白质原有的电荷和形体差异, 从而对蛋白质进行分离。 当对蛋白质样品做SDS-聚丙烯酰胺凝胶电脉分析时,要在样 品中加入含有SDS和B-巯基乙醇的样品处理液。
样品处理液中加入溴酚蓝染料,用于控制电泳的过程。
另外在样品液中加入适量的蔗糖或甘油以增大溶液密度,使加样时,使样品溶液可以沉入样品凹槽底部。
SDS-聚丙烯酰胺凝胶的有效分离范围取决于用于灌胶的聚丙烯酰 胺的浓度和交联度。SDS-聚丙烯酰胺凝胶大多按双丙烯酰胺:丙烯酰胺为了1:29配制,实验表明它能分离大小相差只有3%的多肽。 SDS-聚丙烯酰胺凝胶电脉成功的关键之一是电泳过程中蛋白质 与SDS的结合程度。影响它们结合的因素主要有三个:
(1) 溶液中SDS单体的浓度 SDS在水溶液中是以单体和SDS-多 肽胶束的混合形式存,能与蛋白质分子结合的是单体。单体的浓度 与SDS总浓度、温度和离子强度有关。
(2) 样品缓冲液的离子强度 SDS-PAGE的样品缓冲液离子强度较 低,常为10~100mmol/L
(3) 二硫键是否完全被还原 只有二硫键被彻底还原后,蛋白质 分子才能被解聚,SDS才能定量地结合到亚基上,使蛋白质的相对迁移率和分子量的对数呈线性关系。
2、实验
2.1 实验材料
(1) 器材: 垂直电泳槽,稳压稳流电泳仪/电转仪,蛋 白变性用加热仪器,Tip头,Ep管,碎冰,注射器等。
(2)1.0mol/L Tip· (PH 6.8) HCl
(3)1.5mol/L Tip· (PH 8.8) HCl
(4)10%SDS室温保存:去离子水配制。
(5)10%过硫酸铵(保存):提供驱动丙酰胺和双丙烯酰胺聚合所必需的自由基。由于过硫酸铵会缓慢分解, 应隔周新鲜配制。
(6)TEMED(N,N,N,N’-四甲基乙二胺):催化过硫酸 胺形成自由基而加速丙烯酰胺和双丙烯酰胺的聚合。 (7)5 ×Tris-甘氨酸电泳缓冲液(1000ml):去离子水 500ml,Tris 碱15.1g,甘氨酸94g, 10%(W/V)电泳级SDS 50ml,补去离子水至1000ml。使用前做5×稀释 (8)4×蛋白质电泳上样缓冲液 (9)蛋白质预染Marker
2.1 实验方法
1、制备SDS-PAGE凝胶
(1)准备SDS-PAGE凝胶电泳用玻璃板夹板
(2)配制10% SDS-PAGE分离胶(15ml)
(3) 灌制分离胶
(4)立即用0.1%SDS液覆盖胶面(隔绝空气有助于凝胶 聚合,使凝胶面形成平直),室温放置约40min至分离胶凝固。
(5)配制5%浓缩胶4ml (可以与配制分离胶时同时进行)
(6)倒掉(吸附)0.1%SDS覆盖液,用去离子水冲洗分离 胶表面3~4次,以洗净未聚合的丙烯酰胺(避免在胶顶部 或玻璃夹板中留有气泡),并用吸水纸吸掉残留的液体。
(7) 将凝胶板重新垂直放置,轻轻加入5%积层胶液(注 意避免产生汽泡),插入样品梳,使液面至样品梳上标志位置,室温凝胶约40min.
(8)轻轻拔去梳子,撕去封玻璃夹板用透明带,将玻璃夹 板“凹”面紧贴紧电泳槽,两侧用夹子很好地固定在电泳槽上。用针头式注射注射器吸取电泳缓冲液轻轻冲洗点样孔,以去除未聚合的凝胶,待上电泳。
2、样品变性及电泳
(1)由 -80℃冰箱取出Hela细胞总蛋白样品,立即插入冰中(减少 蛋白降解)待其融化。
(2)吸取细胞总蛋白样品15 ul 加入0.5 ul EP管中,每样品管中分 别加入5ul 4×蛋白质凝胶电泳上样缓冲液,轻轻混合,98℃变性 8min(同时变性标准分子量Marker),立即插入冰中,涡旋数秒, 短暂离心。
(3)吸出变性蛋白液,贴紧加样孔上方,将样品轻轻加入凝胶孔 中。
(4)将电泳仪设置成稳压状态,接通电源,将电压调至100V使样 品通过浓缩胶(电压约8V/cm)。当染料进入分离胶后,将电压调 高到130V(约15V/cm),继续电泳使染料至分离胶适当位置(4℃ 冰箱中进行电泳),结束电泳。
注意事项:
(1)设立必要的蛋白质分子量标志物。
(2)丙烯酰胺和双丙烯酰胺具有很强的神经毒性并容易吸附于 皮肤,其作用具有累积性,故称量时应带手套及口罩。
(3)不同厂家的SDS可引起多肽的迁移图谱变化较大,建议认 准使用某一试剂级别。
(4)一旦加入TEMED,应立即混旋并快速灌注入玻璃夹板。
(5)过硫酸铵会缓慢分解,应隔周新鲜配制。
(6)为保持电泳的平衡,在无样品孔中也应加入适量的4×蛋 白质电泳液。
(7)正确连接电泳连线正、负极方向(负极在上,正 极在下),经保证电荷由负极向正极流动。
(8)凝胶玻璃板要定期做硅化处理:用氯仿或庚烷配 成5%二氯二甲硅烷溶液,用其浸泡或擦拭玻璃板,有机溶剂挥发时,二氯二甲硅烷即沉积在玻璃制品上。使用前用水反复冲洗多次或于180℃烘烤2h。
五、转膜
凝胶电泳结束后,将凝胶上分离到的蛋白条带通过转移电 泳方式转印至固相支持物上,然后分别用非标记一抗及二级 免疫试剂对其进行孵育、检测。
用于印迹法的固相支持物有多种,硝酸纤维素膜、尼龙膜 及PVDF膜较为常用。下面是介绍PVDF(聚偏氟乙烯)膜作为 固相支持物。 转膜的方式有湿转和半干转,下面介绍的湿转方法。
1、实验材料
(1)器材: 转移电泳仪,转仪电泳槽,PVDF膜,剪刀,滤 纸等。
(2)试剂:
①转移缓冲液:Tris 3.03 g,甘氨酸 14.4 g,甲醇 200 ml, 补ddH2O至 1000ml,每次配完可用2~3次。最好现配现用。 4℃ 避光保存。 ②考马斯亮蓝染色液(100ml):考马斯亮蓝 R-250 0.25 g, 甲醇 50ml ,乙酸 10ml,蒸留水 40ml。待考马斯亮蓝R-250 溶解,用Whatman 1号滤纸过滤,以去除颗粒状物质。 ③脱色液:乙酸 10% (V/V),甲醇 50% (V/V),H2O 40% 。
2、实验方法
(1)PDVF 膜及滤纸的预处理:剪裁与胶大小一致的 PVDF膜,将其浸入甲醇液中浸泡10 s(快速激活PDVF 膜),去离子水处理5min,1×转移缓冲液处理10min 以上。
(2)剪裁与胶同样大小的6层滤纸,用转移液缓冲液浸 泡后待用。
(3)取下电泳板,将其平置(使凹面玻璃板在下), 小心取出夹板中的垫片及去掉上层玻璃板,切除多余凝胶,将含样品胶在蒸馏水及1转膜液中各漂洗一次。
(4)转膜: ①将样品胶与膜装入标有正、负极的转膜夹板中:由正 极侧开始,依次为海绵垫片→3层滤纸→PVDF膜→样品胶 →三层滤纸(排除气泡)→海棉垫片,扣紧转膜夹板, 放入含有转膜缓冲液的转移电泳槽中。 ②正确连接转移电泳连线,使电荷由负极向正极流动。 接通电源,恒压状态下,80V 转膜2 h(此操作在4℃冰 箱中进行) ③小心取出转移膜(用铅笔轻轻描出蛋白Marker带), 在1×TBST液中漂洗两次。 ④将凝胶浸入考马斯亮蓝染色液中,检查蛋白转移是否 完全。
注意事项:
(1)开始转移时一定要检查电流大小。过高电流产生的热量 会导致转移失败,通常高电流是由于转移液配制不当造成的。
(2)低离子强度转移缓冲液可使用较高电压,而不会导致高 电流和过热,但转移过程中由凝胶中渗出的电解质可导致转移 缓冲液电导增加,缓冲能力降低。
(3)也可在恒流状态下以200mA转移2h。
(4)若转移中因凝胶变形发生条带扭曲或由于凝胶中电解质 渗出导致过热,可预先将凝胶在转移缓冲液中浸泡。
(5)使用预先染色的蛋白质分子量标准品或转移后将凝胶 染色,可检查转移是否彻底。
(6)对于较大蛋白质,较低的丙烯酰胺浓度可获得较好的 转移效果。
(7)对电转移来说,最常遇到的问题是目的蛋白质转移效 率低,转移效率可由转移后对凝胶或膜染色来进行观察。
六、检测
1、实验器材
(1)器材:摇床,避光盒,洗膜用平皿,X线片,X线片曝 光盒等。
(2)试剂:
① 10×TBST缓冲液:100 mmol/L Tris· (pH 8.0), HCl 1500mmol/L NaCl,0.2% Tween-20,补水至1000ml,高 压灭菌,4℃保存,使用前稀释10倍。
② 5%脱脂奶粉(1×TBST配制)。
③ 一抗:羊抗Actin (使用前用1×TBST稀释200倍)。
④二抗:兔抗羊Ig G/HRP (使用前用1×TBST稀释2000倍)。
⑤ECL试剂盒。
2、实验方法
(1)封闭:将转移后的膜放入5%(W/V)脱脂奶粉中,室温、 摇床上缓慢摇动状态下封闭1h(或4℃过夜)
(2)一抗反应:①将一抗(羊抗Actin) 用1×TBST稀释200 倍);②将封闭后的膜直接放入上述抗体中, 4℃反应过夜。
(3)洗膜:将反应膜放入平皿中,用1×TBST漂洗一次,继 而用1×TBST洗涤3次(室温下缓慢摇动洗涤)以洗净未结合 的一抗,每次换入新液洗涤10min。
(4)二抗反应:①将二抗(兔抗羊 Ig G/HRP )用1×TBST 稀释2000倍;②将经一抗作用过的膜放入上述二抗液体中 (室温、避光缓慢摇动)作用50min(不超过60min).
(5)洗膜:用1×TBST洗膜,方法同(3),洗去二抗。
(6)曝光及洗片: ①按1:1(V/V)混合ECL试剂盒中两种液体,在辣根过氧化物 酶(HRP)催化下,过氧化物酶与 Luminol 增剂反应发强光, 可见信号可以用压片法检测。Western 实验中,HRP标记在二 抗上,与一抗靶蛋白复合物结合,再用底物进行发光检测。 ②将上述混合液均匀铺在PVDF膜表面,室温作用2min,抖掉 膜上液体,将膜用保鲜膜包裹(避免在膜的上面出现气泡) ③在暗室中(红光下),将X线胶片直接压于包裹后的膜上, 曝光适当时间。 ④将曝光后X光线片在清水盘中浸湿→显影液中显影→清水中 漂洗→定影液中定影 5 min(具体曝光时间及显影时间需根据 显影结果作出调整)。
注意事项:
(1)选择合适的一抗及二抗浓度。
(2)选择合适的封闭液。
(3)吸取ECL试剂时要注意更换Tip尖。两种试剂一经混合, 应在内使用。
(4)注意避光操作。
(5)应考滤ECL试剂的发光强度极其衰灭时间,因此请按说 明书及实验具体情况进行。
-
科技前沿

-
综述