Neuron:厦大许华曦教授研究又获重大突破
首批国家“千人计划”获得者、厦门大学神经科学研究所许华曦教授(许华曦教授即将在2015生物医疗大数据高峰论坛上分享题为《阿尔茨海默病的机理研究与药物研发最新进展》的精彩报告!)课题组研究近日又获重大突破,其最新成果“The appoptosin protein mediates a path that leads to the accumulation of tau, a key component of brain lesions”于9月2日正式发表于《Neuron》。该杂志为国际神经学科的顶级权威杂志(去年的SCI影响因子为15.98),也是最为知名的《细胞》子刊。该论文以厦门大学医学院神经科学研究所暨福建省神经退行性疾病及衰老研究重点实验室为第一单位,第一作者为神经科学研究所博士生赵颖俊。其他参与作者包括神经科学研究所的国家“千人计划”获得者卜国军教授和国家杰出青年基金获得者张云武教授。
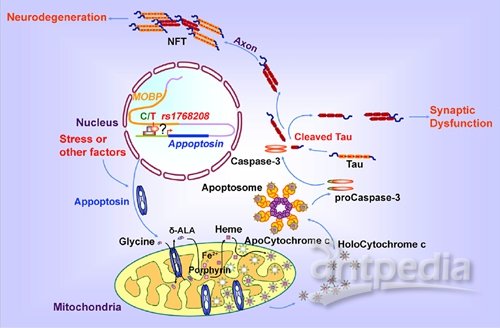
Appoptosin可能通过caspase-3介导Tau蛋白切割,导致Tau蛋白异常聚集和突触功能障碍的Tau疾病
在该研究中,许教授课题组鉴定了一个在Tau疾病中起关键致病作用的新蛋白Appoptosin。Tau疾病是一类具有共同病理特征:即随着疾病的进程,在脑中会产生Tau蛋白异常聚集和缠结的神经退行性疾病,包括阿尔茨海默症(老年性痴呆)、额颞痴呆、以及进行性核上麻痹(PSP)等。虽然人们推测Tau蛋白异常很可能是导致这些疾病中神经元和脑功能受损的关键因素,但是并不清楚它究竟是如何诱发疾病的。尤其是PSP患者在平衡、眼球运动以及思维上都存在严重的障碍,但迄今为止,人们对该疾病的致病机制几乎一无所知。许教授的研究团队通过对PSP患者的检测,发现一个与该疾病相关的DNA单核苷酸突变(SNP)可以引起Appoptosin蛋白水平的增高,并增加Tau蛋白的过度磷酸化以及caspase-3酶介导的Tau蛋白切割,从而导致Tau蛋白的异常聚集和突触功能障碍。更为重要的是,在阿尔茨海默症和额颞痴呆患者的脑组织中,同样发现了致病蛋白Appoptosin和Tau蛋白异常切割的增加,进一步证明了Appoptosin介导的途径在Tau疾病的发病机制中起到了关键性作用。该研究为进一步阐明神经退行性疾病的病理机制指引了新的研究方向,为痴呆和运动功能障碍的临床治疗提供了全新的治疗靶点和思路,具有重要的临床意义。
该论文的发表迅速引起国际媒体的广泛关注,被许多媒体给予报道。在被媒体采访中,许华曦教授说:“Tau蛋白聚集引起的神经纤维缠结对大脑是有害的,可导致中枢神经系统的进行性退化。我们的研究揭示了过量Appoptosin蛋白如何增加Tau蛋白的聚集和神经纤维缠结的具体机制,通过对该机制的进一步了解,我们可以考虑以Appoptosin或Caspase-3作为治疗药物靶点,从源头上抑制致病因素,从而减缓这一类统称为Tau蛋白病的神经退行性疾病的病理进程。”
许华曦教授和卜国军教授领导的神经科学研究所团队经过几年的艰苦奋斗,已经成为国内领先、国际知名的神经退行性疾病研究团队,取得了一系列引人注目的成就,最近2-3年取得的科研成果尤为显着,先后以厦大为第一/通讯作者单位在Nature Medicine、Neuron、Nature Review Neurology、Cell Research、PNAS、Journal of Neuroscience等国际一流学术杂志发表多篇文章,为阐述神经退行疾病的分子机理及建立新的治疗靶点做出了巨大贡献。
-
科技前沿