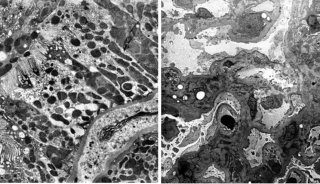
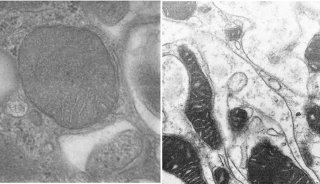
清华施一公院士Science同日发表两篇文章
7月21日,清华大学的施一公(Yigong Shi)院士课题组再度在剪接体研究中取得重大突破,两篇姊妹研究论文同期发表在《科学》(Science)杂志。
在去年8月20日的Science杂志上,施一公团队也同期发表了两篇姊妹研究论文。在第一篇文章中研究人员报道称,采用单颗粒冷冻电子显微镜获得了分辨率为3.6埃的裂殖酵母剪接体的三维结构。在第二篇文章中研究人员阐明了剪接体剪接前体mRNA(pre-mRNA)的机制。
2016年开年,施一公院士领导清华大学生命科学学院、中科院上海生命科学研究院的研究人员报告称,他们获得了分辨率为3.8埃的U4/U6.U5 三小核核糖核蛋白复合物(U4/U6.U5 tri-snRNP)三维结构,由此提供了有关剪接体组装和催化的新见解。研究结果发布在1月7日的Science杂志上。
这些研究工作将分子生物学的“中心法则”在分子机理上的研究上大幅度向前推进,是我国科学家在生命领域做出的重大原创性突破。
DNA是所有生物体遗传信息的载体。称之为基因的DNA特定区域,包含着装配蛋白质所需的信息。在真核生物中,大多数的基因是以一种嵌合样的模式构成:编码蛋白质的DNA部分与所谓的非编码部分间隔交错。为了编码生成蛋白质,首先基因必须转录为pre‑mRNA。随后将这一RNA分子中的非编码部分去除,将编码部分拼接到一起,就生成了所谓的信使RNA(mRNA),这一成熟的RNA指导了蛋白质合成。而至关重要的RNA成熟过程就被称之为“RNA剪接”。 RNA剪接是一个至关重要的生物学机制,至少15%的人类疾病是由于剪接错误所致。RNA剪接过程是通过一种叫做剪接体的高度复杂的分子机器来完成。
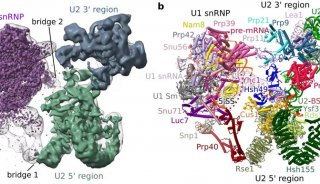
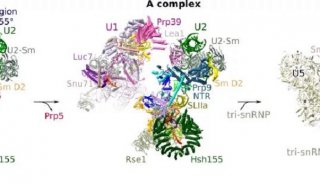
剪接体是一个动态的、复杂的RNA-蛋白质大分子复合物,沉降系数大约为60S,由U1, U2, U4, U5和U6等5个核内小核糖核蛋白(snRNP)和多种其他蛋白质所组成。每个snRNP包含一条核内小RNA(snRNA)和数个或十多个蛋白质。
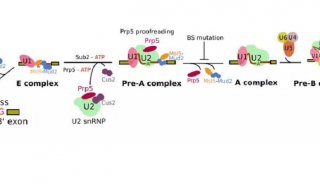
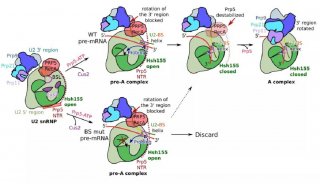
在剪接反应过程中,组成剪接体的大量蛋白质和核酸分子按照高度精确的顺序进行结合和解聚,在此过程中伴随大规模的结构重组。首先,U1结合至内含子的5’拼接点形成复合物E,然后U2结合至分支点(branch site,BS)形成复合物A,接下来U4/U6.U5三聚snRNP装配上去形成复合物B。伴随着U1、U4的陆续解离,剪接体最终成为处于激活状态的复合物Bact和具有催化活性的复合物B*。U6/U2催化酯转移反应,5’拼接点断开,内含子形成套索结构,标志着第一阶段催化反应的完成,形成包含有U2、U5、U6和内含子套索的复合物C。接下来完成第二阶段的酯转移反应,内含子3’位点断开,外显子连接在一起。
在最新的这篇题为“Structure of a yeast catalytically activated spliceosome at 3.5 Å resolution”的Science文章中,研究人员称采用冷冻电子显微镜(cryo-EM)确定了来自酿酒酵母的催化激活剪接体(复合物Bact)的原子结构,平均分辨率达到3.52埃。最终定义的模型包含U2、U5 snRNP,U6 snRNA、NTC、NTC related (NTR)和一条包含71个核苷酸前体mRNA(Pre-mRNA)分子,38个蛋白总共13,505个氨基酸,结合分子量近1.6兆道尔顿。这一结构与早先确定的那些结构勾勒出了前体mRNA剪接反应的一个分子框架。
在第二篇题为“Structure of a yeast catalytic step I spliceosome at 3.4 Å resolution”的Science文章中,研究人员报告称采用冷冻电子显微镜获得了平均分辨率为3.4埃的酿酒酵母催化第一阶段剪接体(复合物C)的原子结构。研究揭示的结构特征描述出了第一阶段催化反应后剪接体的形成,预测了完成第二阶段酯转移反应所需的结构改变。
施一公教授是国际著名的结构生物学家,在细胞凋亡、大分子机器、膜蛋白研究领域占据国际领先地位。曾荣获国际赛克勒生物物理学奖、香港求是基金会杰出科学家奖、谈家桢生命科学终身成就奖、瑞典皇家科学院爱明诺夫奖等多个国内外大奖。2008年施一公放弃国外的优厚条件选择回国,在Nature、Science等国际顶级期刊上发表了多篇论文,同时他也搭建起了以清华大学为中心的人才引入桥梁。现担任中国科学院院士、美国科学院外籍院士和美国艺术与科学院外籍院士。
本月,施一公还领导清华大学生命科学学院的研究人员报告称,采用冷冻电镜获得了平均分辨率为3.5埃(3.5 Å)的人类26S蛋白酶体结构,构建出了核心颗粒(CP)中28个亚基及调节颗粒(RP)中18个亚基的原子模型。此外,他们还用冷冻电镜确定了结合去泛素化酶USP14的人类蛋白酶体的结构,分辨率达到4.35埃(Å)。这些结构为了解真核生物蛋白酶体的功能机制提供了一个框架。这一研究成果发布在7月18日的Nature Structural & Molecular Biology杂志上。
-
焦点事件

-
招标采购

-
招标采购

-
招标采购

-
招标采购

-
市场商机

-
招标采购

-
招标采购

-
招标采购

-
招标采购

-
技术原理

-
焦点事件
-
招标采购

-
招标采购

-
焦点事件

-
企业风采

-
项目成果
-
技术原理