婴儿研究争议促美权衡知情同意条例
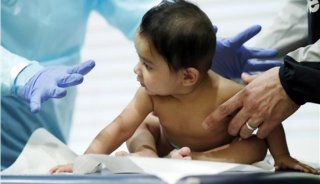
关于知情同意条款的争论源于一项针对早产儿的研究。
伴随一场关于早产儿研究的激烈争论,美国政府正在考虑改变生物医学研究人员告知病人一些临床试验风险的方式。这些规则和争论——使今年的一些新生儿研究被搁置数月——是上周美国健康与人类服务部(HHS)在华盛顿举行的一个长达1天的公众听证会的主题。
这场争论在生物伦理学界分歧很大,也给美国国立卫生研究院(NIH)带来了麻烦。NIH一直资助新生儿研究,和人类研究保护办公室(OHRP)站在对立面。(OHRP是针对研究伦理的联邦监管机构。)相比现有的医疗效果,OHRP聚焦于如何最好地在伦理上对研究进行管理——自从国会在2010年的《平价医疗法案》下又给这类研究拨款11亿美元,OHRP的工作又增加了。
这场争论始于3月,OHRP公开了一封批评SUPPORT主管的信件。SUPPORT是一项耗资2000万美元,囊括23家医院的研究。SUPPORT试图确定通常为早产儿设立的血氧水平和预防严重疾病的关系。
不以营利为目的的监督组织“公共市民”将OHRP的信传播给记者,引起了媒体的广泛关注。OHRP控告研究人员未能向研究中1300名婴儿的父母提供足够的警告。
然而,很多研究人员和NIH并不赞同OHRP的立场。6月,在《新英格兰医学杂志》的一篇社论中,NIH院长Francis Collins认为,考虑到SUPPORT出色的设计和重要性,OHRP的信是不合适的。Collins出乎意料的尖锐话语表明,有13年历史的OHRP 正在被遏制。
研究人员表示,这场争论使一些涉及婴儿的研究中断,与此同时,一些组织者在评估和修改用于获得(病人的)知情首肯的材料。美国国家儿童健康和人类发展研究所(NICHD)新生儿研究协作网的几个研究点停止招募新的病人以开展6个正在进行中的试验。
美国爱荷华大学的Edward F. Bell表示:“OHRP的信引发了大量的详细审查和深刻反省。”