胚系细胞特异性的CRISPR-Cas9基因修饰系统研究中获进展
9月11日,国际学术期刊plant Biotechnology Journal 在线发表了中国科学院上海生命科学研究院植物逆境生物学研究中心朱健康研究组题为Development of germ-line-specific CRISPR-Cas9 systems to improve the production of heritable gene modifications in Arabidopsis 的研究论文。该研究在模式植物拟南芥中开发出了胚系特异性的CRISPR-Cas9基因修饰系统,可以改善拟南芥中可遗传的基因修饰的发生频率和多样性。
近年来,CRISPR-Cas9系统为基因组定点修饰技术带来了革命性的飞跃,该系统已经成功应用于人类、小鼠、斑马鱼、家蚕、果蝇、酵母、拟南芥及水稻等多个物种中。这种定制化内切核酸酶系统包含两个元件:靶向识别DNA的单链向导RNA(sgRNA)及进行DNA切割的Cas9。尽管泛在性表达的CRISPR/Cas9(UC)系统可以高效地生成靶基因修饰,并且将这些基因修饰通过生殖细胞系传递给下一代,但也会伴随产生大量不可遗传的体细胞突变。因此开发和改善胚系细胞特异性的基因修饰系统,将有利于减少体细胞突变发生频率,同时极大地提高目标基因修饰的遗传率。
朱健康研究组设计并利用SPOROCYTELESS (SPL)基因的表达盒构建出了胚系特异性Cas9系统(GSC)系统,该系统可以特异地在雄性配子体中进行基因修饰。通过比较分析GSC和UC两种系统介导4个靶向內源基因位点修饰的效率和特性,发现在T1代植物中GSC系统生成的突变很少(3%),但在T2代群体中检测到大量的突变株(30%),其中70%是可以稳定遗传的杂合子;而利用UC系统生成的T2代突变群体中,大部分(70%)是嵌合体。进一步分析比较其中的两个位点显示,采用GSC系统生成的可遗传基因突变的丰度要比UC系统高37%,并且突变多态性也有显著提高。此外,研究人员还检测了另外两个基于胚系特异性启动子的CRISPR/Cas9系统(pDD45-GT和pLAT52-GT),其中pDD45-GT系统在T1代就能产生可遗传的纯合突变体。这些研究结果表明,未来对这一新的GSC系统的开发和应用将极大地推动植物中针对特定靶基因修饰类型,尤其是致死突变的大规模筛选。
该工作得到了中科院经费的支持。
-
项目成果

-
焦点事件

-
招标采购

-
政策法规
-
综述

-
焦点事件

-
焦点事件

-
企业风采

-
焦点事件

-
会议会展
-
科技前沿
-
精英视角

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
科技前沿

-
项目成果
-
产品技术

-
科技前沿

-
企业风采

-
项目成果
-
精英视角

-
焦点事件

-
焦点事件
-
技术原理

-
焦点事件

-
项目成果
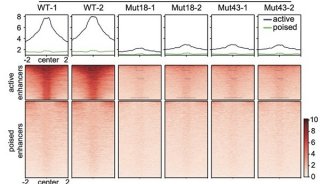
-
项目成果

-
项目成果
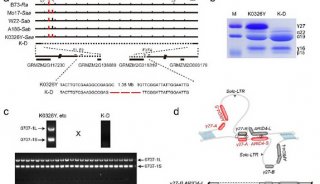
-
项目成果
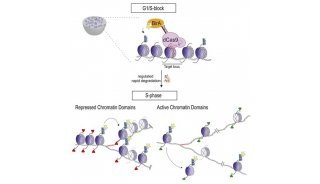
-
产品技术

-
科技前沿

-
科技前沿

-
项目成果