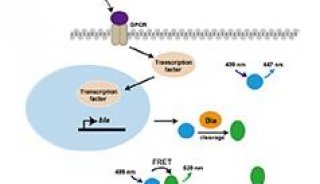
第二军医大学JBC细胞凋亡信号机制
近期来自第二军医大学、吉林大学等机构的研究人员在新研究中,揭示了整合素连接激酶相关磷酸酶(ILKAP)调控细胞生存与凋亡的一条新信号机制。相关论文发表在《生物化学杂志》(JBC)上。
第二军医大学的肖建如(Jianru Xiao)教授和刘铁龙 (Tielong Liu)教授为这篇文章的共同通讯作者。前者主要从事脊柱肿瘤及脊柱伤病的基础临床研究。后者长期从事脊柱外科临床工作及相关研究。
整合素连接激酶相关磷酸酶(ILKAP)是蛋白磷酸酶2C(PP2C)家族的新成员,虽然目前国际上对它的认识还很有限,但初步的研究结果已显示这是一种与细胞凋亡信号通路密切相关的蛋白磷酸酶。ILKAP广泛表达于人体组织中,在骨骼肌、肾脏、肝脏中有高水平的表达。介导细胞凋亡是ILKAP的主要生理功能,因而与肿瘤等疾病的发生、发展存在密切的关系。
一些研究表明,ILKAP可能是通过负调控整合素(integrin)激酶信号通路,以及正调控c-Jun氨基末端激酶/促分裂原活化蛋白激酶(JNK/MAPK)信号通路发挥作用。在以往的研究中,有人证实ILKAP是通过与磷酸化整合素连接激酶1(ILK1)相互作用对整合素蛋白信号进行了负调控,并提出ILKAP可能是一种胞质蛋白。
在这篇文章中,研究人员发现内源性和标记的ILKAP均主要定位于细胞核,核定位信号(NIS)输入蛋白importin介导ILKAP发生了核转运。ILKAP与importin α1、α3和α5发生了直接相互作用。研究人员证实ILKAP的NLS定位在N末端区域第71-86位氨基酸之间。当他们敲除ILKAP蛋白的NLS时,发现会导致ILKAP定位到细胞质中。他们证实Lys-78和Arg-79对于ILKAP与importin α结合至关重要。此外,研究人员还发现核ILKAP与核糖体S6激酶RSK2发生了相互作用,通过抑制RSK2活性,下调RSK2下游底物cyclin D1水平,诱导了凋亡。
这些研究结果表明ILKAP可由importin介导发生核转运,在细胞核中通过调节RSK2信号调控了细胞生存和凋亡。