物理所等在体外构建出肿瘤细胞侵袭组织的三维模型
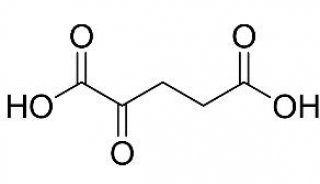
癌症的最大致命性之一在于肿瘤细胞临床上的转移性。肿瘤细胞侵袭和转移过程的研究对于深入理解癌症的致命机理,探索更为有效的治疗手段至关重要。但是肿瘤细胞的侵袭环境和转移过程尤为复杂。如图1所示,肿瘤细胞侵袭的“战场”不仅是一个三维的微环境,而且肿瘤细胞不是单一行动,而是作为群体从营养少、空间狭小等生长条件相对较差的环境,向营养丰富、空间充裕的微环境(如血管等)侵袭。现有的癌症生物实验通常是在培养皿中进行的,其二维生长环境已不足以模拟肿瘤细胞的空间侵袭。倘若能够在活体外构建出肿瘤细胞侵袭的三维物理模型,对于研究细胞侵袭过程中的群体生物行为,理解癌症转移性的机理都具有十分重要的意义。
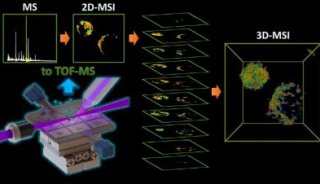
在过去一年,中科院物理研究所/北京凝聚态物理国家实验室(筹)软物质物理重点实验室的刘雳宇特聘研究员与美国普林斯顿大学Robert Austin教授、Moffitt癌症研究所的Robert Gatenby合作,利用微加工工艺在体外构建出一种模拟肿瘤细胞侵袭的三维微环境(如图2所示)。研究人员通过在该三维微环境中构建葡萄糖营养梯度并放置荧光转染过的乳腺癌细胞,同时结合生物共聚焦成像技术,定量比较了转移性肿瘤细胞MDA-MB-231和非转移性肿瘤细胞MCF-7的侵袭特性,并得到在特定葡萄糖浓度梯度下癌细胞进行侵袭的三维轨迹视图(图3)。
在此研究过程中得到了如下的重要发现:1)葡萄糖等浓度梯度将诱导转移性肿瘤细胞侵袭三维外基质,而非转移性肿瘤细胞则不受影响。这也证实了沃伯格效应(Warburg Effect),即细胞的新陈代谢途径从线粒体中丙酮酸氧化的有氧呼吸转变为细胞质中乳酸发酵的低能量效率的厌氧途径,恶性肿瘤内部因此呈现较高的酸性和低含氧量。随着时间的推移,肿瘤的内压力增大,将促使肿瘤细胞适应高压力的环境并寻求新的微环境,导致肿瘤细胞的转移。2)肿瘤细胞群在侵袭细胞外基质时,领头细胞(leading cells)出现了交换周期性交换位置。研究人员认为,这可能表明细胞之间存在着相互协作的博弈行为;3)细胞外间质中掺杂着的荧光颗粒表明,细胞群在侵袭过程中产生了力场。与以前所估计的排斥力相反,这种对细胞外间质的合力是指向细胞群自身的收缩力,并进一步证明肿瘤细胞在侵袭过程中“拉扯”细胞外基质(如图4)。
相关结果发表在《美国国家科学院院刊》上【Proc. Natl. Acad. Sci. USA 10.1073 (2013)】。该工作得到了中国科学院“百人计划”项目的资助。
图1 转移性乳癌细胞侵袭组织向血管转移过程的示意图
图2 (A)根据微加工工艺建立的活体外肿瘤细胞三维侵袭的物理模型;(B)共聚焦显微镜探测到的在模型中形成了稳定葡萄糖梯度。
图3 共聚焦显微镜下乳腺癌细胞入侵细胞外基质的三维重构图像。(A)共聚焦显微镜所拍摄的肿瘤细胞在细胞外间质中的原始图像(垂直于纸面方向); (B)合成三维图像的侧视图显示转移性肿瘤细胞MDA-MB-231在葡萄糖梯度下随时间向纵向侵袭(红色);(C)在无葡萄糖梯度时,MDA-MB- 231细胞停止侵袭;而尽管有葡萄糖梯度,非转移性肿瘤细胞MCF-7依然不侵袭。
图4 在细胞外基质中混入直径约2微米的荧光颗粒后显示MDA-MB-231细胞群侵袭对外基质造成了明显的收缩。
-
项目成果
-
项目成果
-
技术原理